
| A. | 在相同条件下,燃烧等物质的量的C2H4和乙醇,消耗O2体积不相同 | |
| B. | 分子式为C7H8O且属于酚类物质的同分异构体有4种 | |
| C. | 室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯 | |
| D. | 甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼 |
分析 A.根据C2H4和乙醇(C2H6O)完全燃烧,其中C2H6O可以写成C2H4(H2O)来解答;
B.C7H8O遇氯化铁溶液呈紫色,故分子中含有1个苯环,含有酚羟基,则还含有1个甲基,结合甲基与酚羟基的位置关系解答;
C.乙醇与水以任意比互溶,苯酚微溶于水,乙酸乙酯在水中的溶解度很小;
D.苯环对甲基影响,甲基变得活泼,能被氧化.
解答 解:A.相同物质的量的C2H4和乙醇(C2H6O)完全燃烧,其中C2H6O可以写成C2H4(H2O),所以耗氧的量与C2H4的耗氧的量相等,故A错误;
B.芳香族化合物A的分子式为C7H8O,故A含有1个苯环,遇FeCl3溶液可发生显色反应,含有酚羟基,故还含有1个甲基,甲基与酚羟基有邻、间、对三种位置关系,故符合条件的A的结构有3种,故B错误;
C.室温下,乙醇与水以任意比互溶,苯酚微溶于水,乙酸乙酯在水中的溶解度很小,所以室温下,在水中的溶解度:乙醇>苯酚>乙酸乙酯,故C正确;
D.苯环对甲基影响,甲基被氧化成羧基,使酸性高锰酸钾溶液褪色,故D错误;
故选C.
点评 本题考查有机物的结构与性质,注意把握官能团和性质的关系,熟悉醇、苯及苯的同系物、苯酚的性质即可解答,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1mol C nH 2n+2中所含有的共价键数目为(3n+1)N A | |
| B. | 14g 乙烯和丙烯的混合物中含有原子的数目为N A | |
| C. | 标准状况下,1 L戊烷充分燃烧后生成的气态产物的分子数为 $\frac{5}{22.4}$NA | |
| D. | 1.5g 甲基(-CH 3)所含有的电子数是 N A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | B. | 3 mol C+1 mol D+2mol A+1 mol B | ||
| C. | 3mol C+1 mol D+1 mol B | D. | 3 mol C+1 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
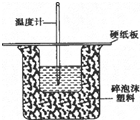 50mL 0.5mol/L盐酸和50mL 0.55mol/L烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.5mol/L盐酸和50mL 0.55mol/L烧碱溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| B. | 向Ca(ClO) 2溶液中通入过量CO 2制取次氯酸:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 向酸性KMnO 4溶液中通入SO 2:2MnO4-+5SO2+4OH -═2Mn2++5SO42-+2H2O | |
| D. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5 ax/b | B. | 5.6 ax/b | C. | 11.2 ax/b | D. | 22.4 ax/b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com