
 .
. .
. (或
(或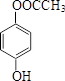 、
、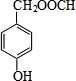 ).
).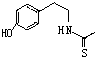 )在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为
)在一定条件下也能发生类似上述第④步骤的环化反应,化合物Ⅶ环化反应产物的结构简式为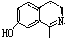 .
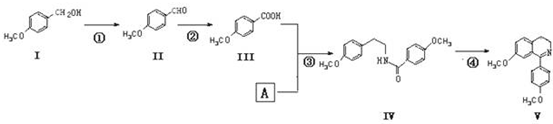
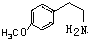
. 分析 根据反应③的产物IV的结构简式逆向分析可知,该反应应从 之间断键,所以A的结构简式为:
之间断键,所以A的结构简式为: ,反应④的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,且双键位置在N原子上,
,反应④的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,且双键位置在N原子上,
(1)根据化合物Ⅱ的结构简式判断其化学式及所含有的官能团名称;
(2)反应①是-CH2OH转化为-CHO,是催化氧化,无机反应物O2,据此写出反应的化学方程式;
(3)根据分析可知判断A的结构简式;
(4)A.化合物Ⅱ苯环和-CHO都能与H2发生加成反应,但没有说明II的量;
B.化合物Ⅱ不能与金属钠反应放出氢气;
C.化合物Ⅰ~Ⅴ含有C和H以外的元素,均不属于芳香烃;
D.化合物Ⅱ含-CHO,能发生银镜反应,;
(5)根据化合物Ⅲ的结构简式、题中限制条件及同分异构体的书写原则形成满足条件的有机物的结构简式;
(6)第④步的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,注意双键位置在N原子上,且本反应物去S.
解答 解:根据反应③的产物IV逆向分析可知,该反应应从 之间断键,所以A的结构简式为:
之间断键,所以A的结构简式为: ,反应④的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,且双键位置在N原子上,
,反应④的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,且双键位置在N原子上,
(1)根据化合物Ⅱ的结构简式可知,其分子中含有1个苯环和1个醛基,其分子式为:C8H8O2,所含有的官能团名称为醛基和醚键,
故答案为:C8H8O2;醛基和醚键;
(2)根据合成流程可知,反应①是-CH2OH转化为-CHO,是催化氧化,无机反应物O2,反应的化学方程式为: ,
,
故答案为: ;
;
(3)根据分析可知,A的结构简式为: ,
,
故答案为: ;
;
(4)A.化合物Ⅱ苯环和-CHO都能与H2发生加成反应,但没有说明II的量,也不能计算消耗H2的量,故A错误;
B.化合物Ⅱ不能与金属钠反应放出氢气,故B错误
C.化合物Ⅰ~Ⅴ含有C和H以外的元素,均不属于芳香烃,故C错误;
D.化合物Ⅱ含-CHO,能发生银镜反应,故D正确;
故答案为:D;
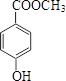
(5)化合物Ⅵ与化合物Ⅲ互为同分异构体,Ⅵ中含有酯基(-COOC-),且能与FeCl3溶液发生显色反应,即苯环带-OH;其苯环上的一氯代物只有2种,说明取代基在对位,故有: 、
、 、
、 三种,
三种,
故答案为: (或
(或 、
、 );
);
(6)化合物Ⅶ(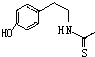 )在一定条件下也能发生类似上述第④步骤的环化反应;根据合成流程可知,第④步的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,注意双键位置在N原子上,其反应物中需要去S,则反应产物为:
)在一定条件下也能发生类似上述第④步骤的环化反应;根据合成流程可知,第④步的环化反应的特征是羰基去O,连接到苯环侧链的邻位上,注意双键位置在N原子上,其反应物中需要去S,则反应产物为: ,
,
故答案为: .
.
点评 本题考查有机合成,题目难度中等,明确合成原理为解答关键,注意熟练掌握常见有机物含有的官能团与性质的关系,(6)为易错点,注意 的环化反应中去的是S原子,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.
的环化反应中去的是S原子,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Z |
| A. | 原子半径:r(Y)>r (Z)>r (W) | |
| B. | Y、Z、W的简单离子的电子层结构相同 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z 的简单气态氢化物的热稳定性比W 的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
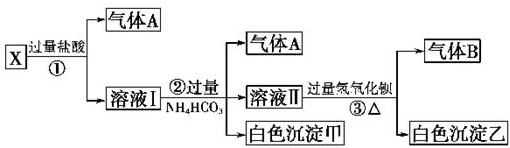
 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z,而离子半径:Z>Y>W | |
| B. | 化合物丙中只存在共价键 | |
| C. | 测得丙的水溶液呈酸性,则溶液中丙盐阳离子浓度大于酸根离子浓度 | |
| D. | 甲沸点远高于乙,可能是甲分子存在氢键所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
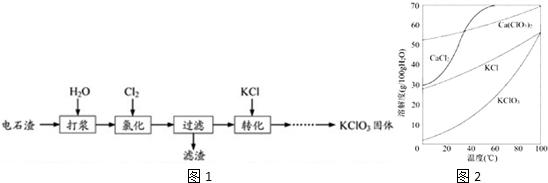
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com