
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)B的氯化物的熔点比D的氯化物的熔点________(填“高”或“低”),理由是____________________。
(3)A的氢化物分子中的中心原子采取________杂化,E的低价氧化物分子的空间构型是________。
(4)F的核外电子排布式是________,F的高价离子与A的简单氢化物形成的配离子的化学式为____________,颜色为____________。
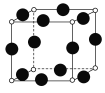
(5)A、F形成某种化合物的晶胞结构如图所示(其中A显-3价),则其化学式为________(每个球均表示1个原子)。
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为________,其晶体中所含的化学键类型为________。
【答案】Na<Al<Si<N高NaCl为离子晶体,而SiCl4为分子晶体sp3V形1s22s22p63s23p63d104s1或[Ar]3d104s1[Cu(NH3)4]2+深蓝色Cu3NAlN共价键
【解析】
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1s22s22p3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1s22s22p63s23p63d104s1,故F为Cu元素,据此解答。
A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.C元素是地壳中含量最高的金属元素,则C为Al元素;A原子核外有三个未成对电子,原子序数小于Al元素,其电子排布式为1s22s22p3,则A为N元素;E原子核外的M层中只有两对成对电子,电子排布式为1s22s22p63s23p4,则E为S元素;化合物B2E的晶体为离子晶体,B应为第ⅠA族元素,且原子序数在N元素和Al之间,则B为Na元素;D单质的晶体类型在同周期的单质中没有相同的,D处于第三周期,故D为Si元素;F原子核外最外层电子数与B相同,其余各层均充满,且原子序数最大,电子排布式为1s22s22p63s23p63d104s1,故F为Cu元素,
(1)在元素周期表中,同一周期元素的第一电离能从左到右呈增大趋势,同一主族元素的第一电离能从上到下逐渐减小,据此可判断四种元素的第一电离能的顺序为:Na<Al<Si<N;
(2)因NaCl为离子晶体,而SiCl4为分子晶体,原子晶体的熔沸点远大于分子晶体的熔沸点,故NaCl晶体熔点高;
(3)A的氢化物为NH3,N原子价层电子对数为3+![]() =4,则N原子采取sp3杂化;E的低价氧化物为SO2,S原子孤电子对数为
=4,则N原子采取sp3杂化;E的低价氧化物为SO2,S原子孤电子对数为![]() =1,价层电子对数为2+1=3,则为V形;
=1,价层电子对数为2+1=3,则为V形;
(4)F为Cu元素,其核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,铜离子与氨气可以配位键形成配离子,其化学式为[Cu(NH3)4]2+;
(5)F为Cu,A为N,且N为-3价,由晶胞结构图可知,N原子在顶点,则N原子数为8×![]() =1,Cu原子在棱心,则Cu原子数为12×
=1,Cu原子在棱心,则Cu原子数为12×![]() =3,所以化学式为Cu3N;
=3,所以化学式为Cu3N;
(6)A、C形成的化合物为AlN,根据化合物具有高沸点和高硬度,是一种新型无机非金属材料,可判断晶体类型为原子晶体,化学键类型为共价键。


科目:高中化学 来源: 题型:
【题目】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。
反应 | 大气固氮N2(g)+O2(g)2NO(g) | 工业固氮N2(g)+3H2(g)2NH3(g) | |||
温度/℃ | 27 | 2 000 | 25 | 400 | 450 |
平衡常数K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:____________________________。
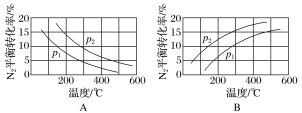
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(p1、p2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较p1、p2的大小关系:________。
Ⅱ.目前工业合成氨的原理是N2(g)+3H2(g)2NH3(g)。
(3)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol。
①达平衡时,H2的转化率α1=________。
②已知平衡时,容器压强为8 MPa,则平衡常Kp=________(用平衡分压代替浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是一种短周期元索,原子半径的大小为:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生右下图转化关系.其中R为10电子分子,是一种常见的无机溶剂。下列说法中不正确的是
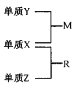
A. X元素位于周期表中第16列
B. X、Y、Z元素两两之间均能形成原子个数比为l:1的化合物
C. X、Y、Z元素形成的单质均具有强还原性
D. R的沸点高于M的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析、归纳、探究是学习化学的重要方法和手段之一。下面就电解质A回答有关问题 (假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a =10时,A溶液呈碱性的原因是(用离子方式程式表示)___________________。
②当a =11,n =1时,A溶液中各种离子浓度由大到小的顺序为_____________________, c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1,溶液中c(HB)∶c(B-)=1∶999时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XY2,测得其饱和溶液中X2+离子的浓度为c mol/L,则该难溶物XY2的溶度积常数为Ksp=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com