


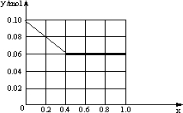
 ,故答案为:0.06;
,故答案为:0.06; .
.


科目:高中化学 来源: 题型:
| A、Ds原子的电子层数为7 |
| B、Ds是超铀元素 |
| C、Ds原子的质量数为110 |
| D、Ds为金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②④ | C、②③ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定次数 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
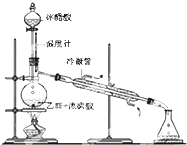 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.
查看答案和解析>>
科目:高中化学 来源: 题型:
 科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:
科学家预言,燃料电池将是21世纪获得电能的重要途径.近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过.其工作原理的示意图如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳氢化合物 | B、二氧化碳 |
| C、可吸入颗粒物 | D、氮氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com