
分析 (1)弱酸在溶液中部分电离,导电能力较弱;
(2)硫酸为二元酸,在溶液中完全电离;加水稀释,氢离子浓度减小;
(3)电离度=$\frac{已电离的醋酸}{醋酸的总浓度}$×100%,根据Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$计算.
解答 解:浓度为0.1mol•L-1的盐酸中c(H+)=0.1mol/L,硫酸中c(H+)=0.2mol/L,醋酸中c(H+)<0.1mol/L,
(1)醋酸是弱酸在溶液中部分电离,其溶液中离子浓度较小,导电能力较弱;
故答案为:醋酸;醋酸;
(2)硫酸为二元酸,在溶液中完全电离,硫酸中c(H+)=0.2mol/L,所以三种溶液中氢离子浓度最大的是硫酸;加水稀释100倍,强酸中氢离子浓度变为原来的$\frac{1}{100}$,弱酸中氢离子要大于原来氢离子浓度的$\frac{1}{100}$,所以加水稀释100倍,氢离子浓度等于0.002mol•L-1的是硫酸;
故答案为:硫酸;硫酸;
(3)醋酸溶液中氢离子浓度为0.004mol•L-1,则醋酸的电离度=$\frac{已电离的醋酸}{醋酸的总浓度}$×100%=$\frac{0.004}{0.1}$×100%=4%,
醋酸的电离常数为Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{0.004×0.004}{0.1-0.004}$=1.6×10-5;
故答案为:4%;1.6×10-5.
点评 本题考查了弱电解质的电离、电离平衡常数的计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意把握电离常数的计算方法.


科目:高中化学 来源: 题型:解答题
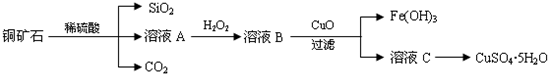
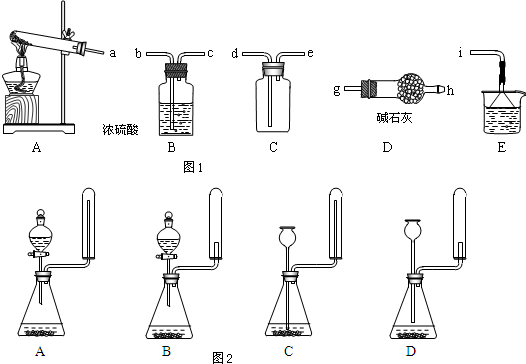
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1氨水中,c(OH-)与c(NH4+)相等 | |
| B. | 0.1 mol/L的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中一定是c(OH-)=c(H+) | |
| D. | 10mL0.02mol•L-1HCl溶液与10mL0.02mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 254gI2(g)中通入2gH2(g),反应放热9.48kJ | |
| B. | 当反应②吸收52.96kJ热量时转移2mole- | |
| C. | 反应②的反应物总能量比反应①的反应物总能量低 | |
| D. | 1mol固态碘与1mol气态碘多了17.00kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 主要仪器 | 试剂 | |
| A | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| B | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| C | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| D | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质需要通电才能发生电离 | |
| B. | 醋酸达到电离平衡时,不存在:CH3COO-+H+?CH3COOH | |
| C. | H2SO4是共价化合物,所以它是弱电解质 | |
| D. | 电离平衡右移,电解质分子的浓度不一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.00 mol NaCl 中含有 6.02×1023个分子 | |
| B. | 1.00 mol NaCl 中,所有Na+的电子总数为 10×6.02×1023 | |
| C. | 欲配制 1.00 L 1.00 mol/L 的NaCl溶液,可将 58.5gNaCl溶于 1.00L 水中 | |
| D. | 电解 58.5g 熔融的 NaCl,能产生22.4L氯气(标准状况)、23.0g 金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸和NaOH溶液反应,生成 lmol水时放热57.3kJ | |
| B. | 含lmolH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57 kJ | |
| C. | 1L0.lmol/L CH3COOH与1L0.lmol/L NaOH溶液反应后放热为5.73kJ | |
| D. | 1L0.lmol/L HNO3与 1L0.lmol/L NaOH溶液反应后放热为 5.73kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com