
【题目】下列关于![]() 的说法正确的是
的说法正确的是
A. 所有碳原子可能共平面 B. 除苯环外的碳原子共直线
C. 最多只有4个碳原子共平面 D. 最多只有3个碳原子共直线
【答案】A
【解析】
根据常见的有机化合物中,甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行共线、共面分析判断,注意单键可以旋转,而碳碳双键和碳碳三键不能旋转。
A.碳碳单键可以旋转,乙炔与乙烯所在的平面一定共面,乙烯所在的平面与苯所在的平面可能在同一平面上,所以所有C原子可能共平面,A正确;
B.乙炔分子是直线型分子,四个原子在同一条直线上,与碳碳三键连接的苯环上的C原子及苯环对位的C原子在同一直线上,与苯环连接的亚甲基C原子取代苯分子的H原子位置,在该直线上,乙烯是平面型结构,键角是120°,所以共线的原子共有2个,因此除苯环外的C原子不可能共直线,B错误;
C.苯分子是平面分子,乙炔是直线型分子,在苯环平面上;乙烯是平面分子,甲基、亚甲基取代乙烯分子中H原子的位置,因此在乙烯分子的平面上,由于碳碳单键可以旋转,乙烯所在的平面与苯所在的平面可能在同一平面上,因此所有C原子可能共平面,C错误;
D.苯分子是平面型结构,苯环处于对位的C原子及与该原子连接的原子在同一直线上,所以苯分子中共线的原子共有4个,乙炔是直线型结构,共线的原子共有4个,乙烯是平面型结构,共线的原子共有2个,最多只有5个C共直线,D错误。
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑧种元素,填写下列空白。
主族\周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | O |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___。
(2)④与⑤两种元素相比较,原子半径较大的是___(填元素符号);在非金属元素的最高价氧化物所对应的水化物中,酸性最强的化合物是___(填化学式)。在金属元素氧化物所对应的水化物中,碱性最强的化合物是___(填化学式),具有两性的化合物是___(填化学式)。
(3)④,⑤,⑥,⑦四种元素形成的简单离子,半径由大到小的顺序为___(填化学式)。
(4)元素①和元素⑦形成化合物属于___化合物(填“离子”或者“共价”)。请用电子式表示⑥和④组成化合物的形成过程:________。
(5)由②和氢元素形成的两种多原子分子,A为10电子结构B为18电子结构,B可由A与次氯酸钠反应制得,该反应的离子方程式为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 生成物的总能量大于反应物的总能量时,ΔH<0
B. 在其他条件不变的情况下,使用催化剂可以改变反应的焓变
C. ΔH<0、ΔS >0的反应在低温时不能自发进行
D. 一个化学反应的ΔH只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时达到平衡并测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时达到平衡并测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为________mol/L。
(2)前5min内用B表示的化学反应速率v(B)为_____mol/(L·min)。
(3)化学方程式中n值为________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(B)=6mol/(L·min) ②v(A)=5mol/(L·min)
③v(C)=4.5mol/(L·min) ④v(D)=8mol/(L·min)
其中反应速率最快的是_____(填编号)。
(5)相同条件下,密闭容器内开始时与平衡时的压强比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙醇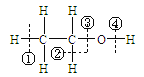 在化学反应中断键位置说法错误的是 ( )
在化学反应中断键位置说法错误的是 ( )
A. 乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应。
B. 乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难失去氢离子。
C. 乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应属于取代反应。
D. 乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属和金属材料的说法正确的是( )
A.铜具有良好的导电性,可以用来做导线
B.铜的化学性质不活泼,在潮湿空气中也不会生锈
C.废旧电池可以随处扔,不会对环境造成污染
D.铝合金门窗是用纯的金属铝材料制成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,根据判断出的元素回答问题:
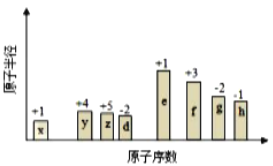
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式____________________。
(4)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图所示:
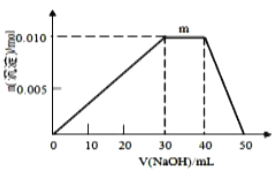
①R中存在的化学键有________________。
②写出m点反应的而离子方程式________________________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后产生沉淀的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于取代反应的是( )
①CH3CH2CH3+Br2![]() CH3CH2CH2Br+HBr
CH3CH2CH2Br+HBr
②C4H10+![]() O2
O2![]() 4CO2+5H2O
4CO2+5H2O
③CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
④C6H6+HNO3![]() C6H5NO2+H2O
C6H5NO2+H2O
A. ①② B. ①③④ C. ②③ D. ②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com