
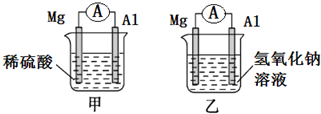
 有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性,两人均使用相同镁片与铝片作电极,甲同学将电极放入2mol/L H2SO4溶液中,乙同学将电极放入2mol/L的NaOH溶液中,如图所示.分析 (1)甲同学将电极放入2mol/L H2SO4溶液中,镁比铝活泼,甲池中正极发生还原反应,电极反应式:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极、镁作正极,负极上铝失电子发生氧化反应;
(3)根据作负极的金属活泼性强结合电池中的负极判断;
(4)A.原电池正负极与电解质溶液有关;
B.镁的金属性大于铝;
C.该实验说明金属活动性顺序已过时,已没有实用价值
D.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析.
解答 解:(1)甲同学将电极放入2mol/L H2SO4溶液中,镁比铝活泼,甲池中正极发生还原反应,电极反应式:2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)乙池中铝易失电子作负极,负极上铝失电子发生氧化反应,电极反应式为:Al+4OH--3e-=AlO2-+2H2O,镁作正极,正极发生还原反应,总反应为2Al+2OH-+2H2O=AlO2-+3H2↑,
故答案为:Al+4OH--3e-=AlO2-+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)甲中镁作负极、乙中铝作负极,根据作负极的金属活泼性强判断,甲中镁活动性强、乙中铝活动性强,故答案为:Mg;Al;
(4)a.根据甲、乙中电极反应式知,原电池正负极与电解质溶液有关,故正确;
b.镁的金属性大于铝,但失电子难易程度与电解质溶液有关,故错误;
c.该实验对研究物质的性质有实用价值,故错误;
d.该实验说明化学研究对象复杂,反应与条件有关,电极材料相同其反应条件不同导致其产物不同,所以应具体问题具体分析,故正确;
故答案为:ad.
点评 本题考查金属活泼性及探究原电池原理,为高频考点,明确原电池中各个电极上发生的反应是解本题关键,注意不能根据金属的活动性强弱判断正负极,要根据失电子难易程度确定负极为易错点,题目难度中等.


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:高中化学 来源: 题型:实验题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  |  |  | 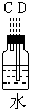 | 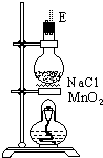 | 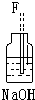 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 108:1:108 | B. | 1:1:108 | C. | 1:108:1 | D. | 1:108:108 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AB2分子的空间构型为V形 | |
| B. | AB2与H2O相比,AB2的熔、沸点比H2O的低 | |
| C. | AB2分子中无氢原子,分子间不能形成氢键,而H2O分子间能形成氢键 | |
| D. | A-B键为极性共价键,AB2分子为非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由乙烯生成乙醇属于加成反应 | B. | 2-甲基丁烷也称异丁烷 | ||
| C. | 油脂和蛋白质都属于高分子化合物 | D. | C4H9Cl有3种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用氯化铵和熟石灰制氨气:NH4++OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 铜与浓硫酸反应:Cu+2H+$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++H2↑ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 铜与稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com