
| A�����³�ѹ�£�2.24L ���������������������Һ��ȫ��Ӧת�Ƶĵ�����Ϊ0.1NA |
| B��30g����ͼ�ȩ�Ļ��������ԭ����ΪNA |
| C��25��ʱ��2L0.1mol/L��Na2CO3��Һ�к��е�CO32-����Ϊ0.2 NA |
| D��ij�ܱ�������ʢ��0.2molSO2��0.1molO2����һ�������³�ַ�Ӧ������SO3������Ϊ0.2 NA |
| m |
| M |
| m |
| M |
| 30g |
| 30g/mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CaO |
| B��Fe2O3 |
| C��Na2O |
| D��Al2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ʱ���������� |
| B��������̼����������ɵ�����ЧӦ |
| C��ʯ���ͷų��ķ������к����� |
| D�������ϼ��ͷų��ļ�ȩ���к����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
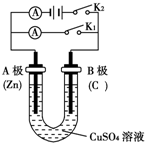 �밴Ҫ��ش��������⣮
�밴Ҫ��ش��������⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢ� | B���ڢۢ� |
| C���٢ڢۢ� | D��ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ư����Һ�ڿ�����ʧЧ��ClO-+CO2+H2O=HClO+HCO3- | ||||
B����Ũ������MnO2��Ӧ��ȡ����������MnO2+2H++2Cl-
| ||||
| C����NaAlO2��Һ��ͨ�����CO2��Al��OH��3��AlO2-+CO2+2H2O=Al��OH��3��+HCO3- | ||||
| D��ϡ�������ͭƬ�ϣ�Cu+2H+��Cu2++H2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com