
已知下列元素的半径为:
| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是( )
A.1.10×10-10m B.0.80×10-10m C.1.20×10-10m D.0.70×10-10m
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面合成乙醇,反应原理为:
CH2=CH2(g) + H2O(g)  CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是 ( )
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是 ( )
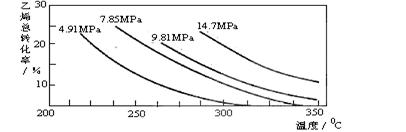
A.合成乙醇的反应一定为吸热反应
B.目前工业上采用250~300℃,主要是在此温度下乙烯的转化率最大
C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率
D.相同催化剂下,在300℃ 14.7MPa乙醇产率反而比300℃ 7MPa低得多,是因为加压平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
化工厂的设计是将实验室的研究成果转化为工业化生产的重要的基础工作。
(1)以硫铁矿为原料生产硫酸需经过 、 和 三个主要生产阶段。
(2)侯氏制碱法是在索尔维制碱法的基础上创造出的一种新的制造纯碱的方法。具体工艺流程图如下:
①索尔维制碱法的原理是 。(用化学方程式表示)
②侯氏制碱法与索尔维制碱法相比,优点是 。
③侯氏制碱法可以循环使用的物质有 。
(3)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。
电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中错误的是( )
A.次氯酸的电子式: B.S2-的结构示意图:
B.S2-的结构示意图:
C.O—18的原子符号: D.CO2分子的结构式:O=C=O
D.CO2分子的结构式:O=C=O
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数在1~18之间的四种元素甲、乙、丙、丁,其最外层电子数的总和为13,甲、乙和丙是具有相同电子层数的相邻元素,则丁一定不是( )
A.氢 B.碳 C.氧 D.氯
查看答案和解析>>
科目:高中化学 来源: 题型:
1L某溶液中存在下列离子:Ba2+、Fe2+、Al3+、Fe3+、Mg2+ 、HCO3-、CO32-、Cl-、NO3-、SO42- 中的五种,浓度均为0.1mol/L,若向原溶液中加入足量的盐酸,有气体生成。经分析知:反应后的溶液中的阴离子的种类没有变化。则下列说法正确的是
A.原溶液中一定含有HCO3-或CO32-
B.原溶液中可能含有Ba2+、Al3+
C.若向原溶液中加入过量的稀硫酸和KSCN溶液,溶液不显血红色
D.若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥并灼烧至恒重,得到固体的质量为12g

查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关含铜化合物的说法错误的是(设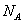 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
A.用盐酸可以洗去铜表面的铜锈
B. 0.1mol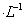 的CuSO4溶液中,Cu2+的数目一定小于0.1
的CuSO4溶液中,Cu2+的数目一定小于0.1
C.在CuCl2和FeCl3的混合溶液中加入铁粉,若有固体残留,则其中一定含有铜
D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明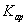 (CuS)远小于
(CuS)远小于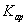 (FeS)
(FeS)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com