


科目:高中化学 来源: 题型:
| 元素 | 锌 | 锰 | 铁 | 铜 | 碳 | 其它 |
| 质量百分含量 | 13~27 | 14~28 | 23~26 | 0.5~0.7 | 5~6 | 13 |
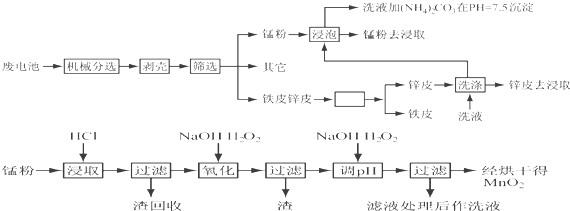
| 离子 | Fe3+ | Fe2+ | Cu2+ | Mn2+ |
| pH | 3.2 | 9.0 | 6.7 | 10.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
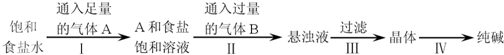
| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是Na2CO3?10H2O |
| C、第Ⅱ步的离子方程式为Na++NH3?H2O+CO2═NaHCO3↓+NH4+ |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
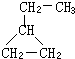 可表示为
可表示为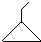 ,则金刚乙烷、金刚乙胺的结构简式可用下图表示.
,则金刚乙烷、金刚乙胺的结构简式可用下图表示.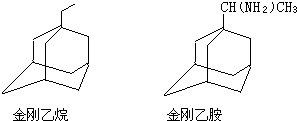
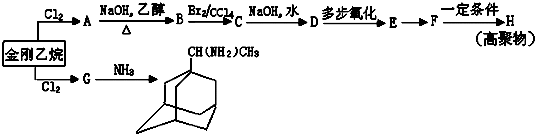
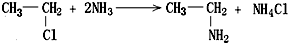
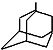 ,如金刚乙烷表示为R-CH2CH3)
,如金刚乙烷表示为R-CH2CH3)查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 有关性质或结构信息 |
| X | 基态原子的最外层电子排布式为nsnnpn |
| Y | 双原子分子单质在标准状况下密度为1.429g/L |
| Z | 所在周期的单核离子中半径最小 |
| W | 该元素原子有1个未成对的p电子 |
| T | 其单质和合金常用于航天工业和航海工业,其单质被誉为“21世纪金属”,其核外电子排布次外层电子数是最外层电子数的5倍 |
| 1 |
| 3 |
| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶解、过滤、蒸发、洗涤 |
| B、溶解、过滤、洗涤、烘干 |
| C、溶解、蒸发、洗涤、过滤 |
| D、溶解、洗涤、过滤、烘干 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、称取碳酸钠晶体100 g |
| B、定容时俯视观察刻度线 |
| C、移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗 |
| D、定容后,将容量瓶振荡均匀,静置发现液面低于刻度线,于是又加入少量水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、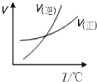 表示的反应速率随温度变化的关系可知该反应的△H>0 |
B、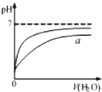 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸 |
C、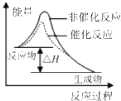 表示该反应为放热反应.且催化剂能降低反应的活化能、改变反应的焓变 |
D、 中开关K置于a或b处均可减缓铁的腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com