
| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
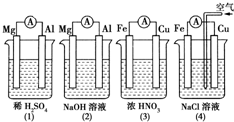
| A. | (1)(2)中Mg作负极,(3)(4)中Fe作负极 | |
| B. | (2)中Mg作正极,电极反应式为:6H2O+6e-═6OH-+3H2↑ | |
| C. | (3)中Fe作电池负极,电极反应式为:Fe-3 e-═Fe3+ | |
| D. | (4)中Cu作正极,电极反应式为:2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
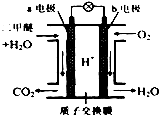 二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A. | a电极为该电池负极 | |
| B. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| C. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ | |
| D. | O2在b电极上得电子,电极反应式:O2+4e-+2H2O═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式:Ca+2Cl--2e-=CaCl2 | |
| B. | 放电过程中,OH-向负极移动 | |
| C. | 放电时,电流由钙电极流向硫酸铅电极 | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水呈碱性:NH3•H2O=NH4++OH- | |
| B. | 碳酸氢钠治疗胃酸过多:HCO3-+H+=CO2↑+H2O | |
| C. | 久置的浓硝酸呈黄色:4HNO3=4NO2↑+O2↑+2H2O | |
| D. | 久置碳酸氢铵有刺激性气味:NH4HCO3=NH3↑+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

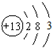 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、H2SO4、H2SO3、H2S、S | B. | SO2、H2SO3、H2SO4、H2S、S | ||
| C. | SO2、H2SO3、H2SO4、SO3、S | D. | SO2、H2SO3、H2SO4、SO2、S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com