
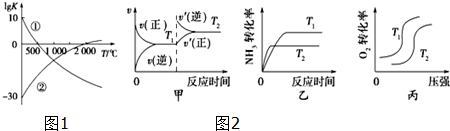
���� ��1��A������ͼ��ٿ�֪�¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶ȣ�ƽ�������ƶ����淴Ӧ���������ȷ�Ӧ����÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����¶�Խ�ߣ�ƽ�ⳣ��Խ��˵�������¶ȣ�ƽ�������ƶ�������Ӧ���������ȷ�Ӧ��
B�������£�����N��N�ļ��ܺ�H-H��O=O�ļ��ܶ��ܴ����Է�Ӧ�٢ڵķ�Ӧ���ʲ���
C�������¶ȣ������Ƿ��ȷ�Ӧ�������ȷ�Ӧ����Ӧ���ʶ�����
D���ڳ����£�����ƽ�ⳣ����֪�����÷�Ӧ�ٹ̵������÷�Ӧ�ڹ̵���Ӧ�̶����ܴ�
��2�����ݷ�Ӧ����ʽ��֪���ڷ�Ӧ��N2�õ����ӣ��������������Ӧ��������������������OH-ʧȥ���ӱ��������缫��Ӧʽ��4OH--4e-=2H2O+O2�� ��2H2O-4e-=O2��+4H+��
��3������-�٣���2��3�������ɵã�2H2��g��+O2��g��=2H2O��l����H=-��92.4+a����2��3=-571.6 kJ/mol����a=+765.0KJ/mol��
��4���������¶ȣ�����Ӧ���淴Ӧ�Ļ�ѧ��Ӧ���ʶ��ӿ죬�ﵽƽ������Ҫ��ʱ�����̣����Լ״������ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ���ƶ�ԭ����֪�������¶ȣ�ƽ�������ƶ����ﵽƽ��ʱNH3��ת���ʽ��ͣ��Ҵ��÷�Ӧ������Ӧ�������������ķ�Ӧ����������������ʱ������ѹǿ��ƽ�������������С���淴Ӧ�����ƶ�������O2��ת���ʽ��ͣ�����
�ڸ�ȼ�ϵ�صĸ�������������Ӧ�����ݷ���ʽ��֪NH3�ڷ�Ӧ��Ԫ�صĻ��ϼ����ߣ�ʧȥ���ӣ�������������ڸ����ĵ缫��Ӧʽ��2NH3-6e-+6OH-�TN2��+6H2O��
��5����ҵ�Ϻϳɰ�ʱ���¶ȹ��ߣ������IJ��ʽ��ͣ��������ںϳɰ�������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����Ը÷�Ӧ��˵��ƽ�������ƶ������Ժϳɰ�ʱ���¶ȹ��ߣ������IJ��ʽ��ͣ�
��� �⣺��1��A������ͼ��ٿ�֪�¶�Խ�ߣ�ƽ�ⳣ��ԽС��˵�������¶ȣ�ƽ�������ƶ����淴Ӧ���������ȷ�Ӧ����÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����¶�Խ�ߣ�ƽ�ⳣ��Խ��˵�������¶ȣ�ƽ�������ƶ�������Ӧ���������ȷ�Ӧ����A����
B�������£�����N��N�ļ��ܺ�H-H��O=O�ļ��ܶ��ܴ����Է�Ӧ�٢ڵķ�Ӧ���ʲ���B����
C�������¶ȣ������Ƿ��ȷ�Ӧ�������ȷ�Ӧ����Ӧ���ʶ�����C����
D���ڳ����£�����ƽ�ⳣ����֪�����÷�Ӧ�ٹ̵������÷�Ӧ�ڹ̵���Ӧ�̶����ܴ�D��ȷ��
�ʴ�Ϊ��D��
��2�����ݷ�Ӧ����ʽ��֪���ڷ�Ӧ��N2�õ����ӣ��������������Ӧ��������������������OH-ʧȥ���ӱ��������缫��Ӧʽ�ǣ�4OH--4e-=2H2O+O2�� ��2H2O-4e-=O2��+4H+��
�ʴ�Ϊ��������4OH--4e-=2H2O+O2�� ��2H2O-4e-=O2��+4H+��
��3����N2��g��+3H2O��l���T2NH3��g��+$\frac{3}{2}$O2��g����H=a kJ/mol��
��N2��g��+3H2��g���T2NH3��g����H=-92.4kJ/mol��
2H2��g��+O2��g���T2H2O��l����H=-571.6kJ/mol����-�٣���2��3�������ɵã�2H2��g��+O2��g��2H2O��l=����H=-��92.4+a����2��3=-571.6 kJ/mol����a=+765.0KJ/mol��
�ʴ�Ϊ��+765.0KJ��
��4���������¶ȣ�����Ӧ���淴Ӧ�Ļ�ѧ��Ӧ���ʶ��ӿ죬�ﵽƽ������Ҫ��ʱ�����̣����Լ״������ڸ÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ������ƽ���ƶ�ԭ����֪�������¶ȣ�ƽ�������ƶ����ﵽƽ��ʱNH3��ת���ʽ��ͣ��Ҵ��÷�Ӧ������Ӧ�������������ķ�Ӧ����������������ʱ������ѹǿ��ƽ�������������С���淴Ӧ�����ƶ�������O2��ת���ʽ��ͣ�����
�ʴ�Ϊ���ң�
�ڸ�ȼ�ϵ�صĸ�������������Ӧ�����ݷ���ʽ��֪NH3�ڷ�Ӧ��Ԫ�صĻ��ϼ����ߣ�ʧȥ���ӣ�������������ڸ����ĵ缫��Ӧʽ��2NH3-6e-+6OH-�TN2��+6H2O��
�ʴ�Ϊ��2NH3-6e-+6OH-�TN2��+6H2O��
��5����ҵ�Ϻϳɰ�ʱ���¶ȹ��ߣ������IJ��ʽ��ͣ��������ںϳɰ�������Ӧ�Ƿ��ȷ�Ӧ�������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����Ը÷�Ӧ��˵��ƽ�������ƶ������Ժϳɰ�ʱ���¶ȹ��ߣ������IJ��ʽ��ͣ�
�ʴ�Ϊ���ɹ�ҵ�ϳɰ���ӦN2��g��+3H2��g��?2NH3��g����H=-92.4 kJ/mol��֪�÷�Ӧ������ӦΪ���ȷ�Ӧ���¶ȹ���ʱ������ƽ�������ƶ�����������IJ��ʽ��ͣ�
���� ���⿼���Ȼ�ѧ����ʽ����д���¶ȶ�ƽ���Ӱ�졢ԭ��� ԭ����Ӧ�á���Ӧ������ѡ�������ʲ��ʵĹ�ϵ��֪ʶ�����ջ����ǹؼ�����Ŀ�Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ���ʣ��������ɷŻ�ԭ�Լ�ƿ�� | |
| B�� | �ո��п����Ƶ�����ɫ�����ܿ�䰵 | |
| C�� | ��Ȼ����������̬���ƴ��� | |
| D�� | ���ڿ����м������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ɰ�ɫ����������������ˮ�������ʧ | |
| B�� | ���ɵij���ΪAgCl����������ˮ�������ڰ�ˮ�����µ����Ag+��Cl- | |
| C�� | ���ɵij�����AgCl�����백ˮ�������˿����Ե������[Ag��NH3��2]Cl | |
| D�� | ����AgNO3��Һ��ֱ�ӵμӰ�ˮ������������Ҳ���ȳ��ְ�ɫ�����������ʧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������չ��̵�β�����պ������������ | |
| B�� | ���������У���6 mol CuFeS2��ȡ6 mol Cuʱ������15 mol O2 | |
| C�� | �ڷ�Ӧ2Cu2O+Cu2S�T6Cu+SO2���У�ֻ��Cu2O�������� | |
| D�� | 1200������Cu2S��Cu2O������CuO�������Ǹ�����+1��ͭ���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ��װ��ʵ�ֻ�ѧ������ܵ�ת�� | |
| B�� | �õ�ص��ܷ�ӦΪ2NO+O2�T2NO2 | |
| C�� | NiO�缫�ĵ缫��Ӧʽ��NO+O2--2e-�TNO2 | |
| D�� | ����2.24L��O2���뷴Ӧʱ��ת����0.4mole- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol Cl2�μӷ�Ӧת�Ƶ�����һ��Ϊ2NA | |
| B�� | �ڷ�ӦKIO3+6HI�TKI+3I2+3H2O�У�ÿ����3 mol I2ת�Ƶĵ�����Ϊ6NA | |
| C�� | ���ݷ�Ӧ��HNO3��ϡ��$\stackrel{����ԭ}{��}$NO����HNO3��Ũ��$\stackrel{����ԭ}{��}$NO2��֪��������HNO3��ϡ����HNO3��Ũ�� | |
| D�� | ���д���NO3-����Һ�У�����ͬʱ��������H+��Fe2+��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ��ϩ | C�� | ���Ȼ�̼ | D�� | �ױ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ȼ����Ӹֹ���Ҫ���õ��ǹ��� | |
| B�� | �������������DZ�������CO2������ת��ɻ�ѧ�ܵĹ��� | |
| C�� | 1g����ȼ������Һ̬ˮ���ų�������Ϊ142.9 kJ��������ȼ���ȵ��Ȼ�ѧ����ʽ���Ա�ʾΪ��H2��g��+$\frac{1}{2}$O2��g���TH2O��g����H=-285.8 kJ/mol | |
| D�� | ���¶ȡ�ѹǿһ���������£��Է���Ӧ�������H-T��S��0�ķ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ��ȩ | C�� | CO | D�� | CO2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com