
实验 序号 | 时间/min 浓度/mol•L-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
分析 (1)根据平均化学反应速率公式计算;50min与40min时A的浓度相等,说明已经达到平衡状态;
(2)实验1、2起始量相同,平衡浓度相同,但实验2达到平衡所需要的时间短,反应速率快;
(3)依据实验1、3比较实验数据可知,实验3温度高反应速率快,A转化率增大.
解答 解:(1)实验1中,在10〜20min内,以物质A表示的平均反应速率为:v(A)=$\frac{△c}{△t}$=$\frac{(0.8-0.67)mol/L}{10min}$=0.013mol/(L•min);
根据表中数据可知,40min以后A的浓度不再变化,说明40min后达到平衡状态,则50min时,v(正)=v(逆),
故答案为 0.013;=;
(2)实验1、2起始量相同,温度相同,平衡浓度相同,但实验2达到平衡所需要的时间短,反应速率快,说明加入了催化剂,加快反应速率,平衡不变,
故答案为:快;实验2中使用了催化剂;
(3)实验1、3起始量相同,但实验3达到平衡所需要的时间短,反应速率增大,根据图表可知,实验3温度比实验1高,
故答案为:快;实验3的温度更高.
点评 本题考查化学平衡的简单计算,题目难度不大,明确化学反应速率概念、化学平衡及其影响为解答关键,试题培养了学生的分析、理解能力及化学计算能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:填空题
 ,该结构二氯代物有3种(不考虑立体异构).
,该结构二氯代物有3种(不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
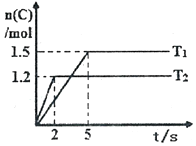 现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)?2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是( )| A. | T1<T2 | |
| B. | 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等 | |
| C. | 温度为T2时,2s内B的平均速率为0.3mol•L-1•s-l | |
| D. | 温度为T1时,达平衡时反应物A的转化率为60% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
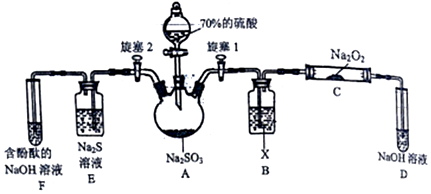
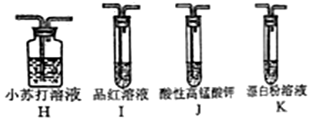
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应2A(s)+B(g)?2C(g)△H>0 能自发进行,原因是△S<0 | |
| B. | 催化剂能改变反应的途径,但不能改变反应的△H | |
| C. | S(g)+O2(g)═SO2(g)△H1<0 S(s)+O2(g)═SO2(g)△H2<0 则△H1>△H2 | |
| D. | 化学平衡CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),增加H2O的浓度H2O的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠露置在空气中,光亮表面颜色变暗:4Na+O2═2Na2O | |
| B. | 硫酸铵溶液与氢氧化钡溶液混合,产生气体:NH4++OH-═NH3↑+H2O | |
| C. | 铝条插入烧碱溶液中,开始没有明显现象:Al2O3+2OH-═2AlO2-+H2O | |
| D. | 碘化银悬浊液滴加硫化钠溶液,黄色沉淀变成黑色:2AgI+S2-═Ag2S+2I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com