
【题目】把一定量的Na2O2和NaHCO3混合粉末分为两等份,将其中一份加入到200mL稀盐酸中恰好完全反应,生成干燥的气体2.24L(标准状况),再将此气体通入到另一份混合物中,充分反应后,气体减少为2.016L(标准状况),则原混合粉末中Na2O2和NaHCO3的物质的量之比为;原稀盐酸的物质的量浓度(mol/L)是 .
【答案】8:1或2:9;1.7mol/L或0.65mol/L
【解析】解:2.24L混合气体的物质的量为 ![]() =0.1mol,2.016LO2的物质的量为:
=0.1mol,2.016LO2的物质的量为: ![]() =0.09mol,则:
=0.09mol,则:
2Na2O2+ | 2CO2=2Na2CO3+ | O2 | 气体物质的量减小△n |
2 | 2 | 1 | |
n | m | 0.1mol﹣0.09mol=0.01mol |
则:n=m=0.02mol,
①若CO2完全反应,则第一份生成CO2的为0.02mol,O2为:0.1mol﹣0.02mol=0.08mol,则:
2Na2O2+ | 4HCl=4NaCl+2H2O+ | O2 |
0.16mol | 0.32mol | 0.08mol |
NaHCO3+ | HCl=NaCl+H2O+ | CO2 |
0.02mol | 0.02mol | 0.02mol |
混合物中过氧化钠与碳酸氢钠的物质的量之比为:0.16mol:0.02mol=8:1;
两个反应中消耗的HCl的物质的量为:0.32mol+0.02mol=0.34mol,则盐酸的物质的量浓度为: ![]() =1.7mol/L;
=1.7mol/L;
②若CO2未完全反应,则Na2O2应是0.02 mol,
2Na2O2+ | 4HCl=4NaCl+2H2O+ | O2 |
0.02mol | 0.04mol | 0.01mol |
则第一份生成O2的为0.01mol,所以CO2为0.1mol﹣0.01mol=0.09mol,
NaHCO3+ | HCl=NaCl+H2O+ | CO2 |
0.09mol | 0.09mol | 0.09mol |
混合物中过氧化钠与碳酸氢钠的物质的量之比为:0.02mol:0.09mol=2:9;
所以消耗的HCl为 0.04mol+0.09mol=0.13mol,物质的量浓度为: ![]() =1.3mol/L,
=1.3mol/L,
故答案为:8:1或2:9;1.7mol/L或0.65 mol/L.
第一份发生反应①2Na2O2+4HCl=4NaCl+2H2O+O2 、②NaHCO3+HCl=NaCl+H2O+CO2,生成气体为O2与CO2.将第一份生成的干燥气体,通入第二份Na2O2的NaHCO3的混合粉末,发生反应2Na2O2+2CO2=2Na2CO3+O2,根据气体物质的量差量利用差量法计算参加反应的二氧化碳、过氧化钠的物质的量,再讨论二氧化碳是否过量进行计算.


科目:高中化学 来源: 题型:
【题目】如图是某学校实验室从化学试剂商品店买回的硫酸试剂标签上的部分内容,据此,下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2 molL﹣1
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 molL﹣1的稀硫酸需取该硫酸50.0 mL
D.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢与浓硫酸的反应为3H2S+H2SO4=4S↓+4H2O,下列说法正确的是( )
A. 硫化氢气体被氧化成硫B. 硫酸被氧化成硫
C. 硫酸被还原成水D. 硫化氢气体被还原成水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是( )
实验 | 现象 | 结论 | |
A. | 向2 mL 0.1 | 黄色逐渐消失,加KSCN溶液颜色不变 | 还原性: |
B. | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C. | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D. | 向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和Nal溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 |
|
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3-242kJ·mol-1
O2(g)= H2O(g) ΔH3-242kJ·mol-1
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是、;590℃之后,丁烯产率快速降低的主要原因可能是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列试剂中,能够鉴别BaCl2 、NaCl 、Na2CO3的最佳试剂是( )
A. 稀盐酸 B. NaOH溶液 C. 稀硫酸 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( ) 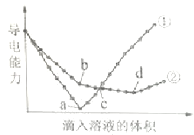
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH﹣
C.c点,两溶液中含有相同量的OH﹣
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,纯水中的c(H+)=2.0×10﹣7mol/L,此时溶液的c(OH﹣)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10﹣4mol/L,则溶液中,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com