
【题目】现有1﹣20号元素A、B、C、D所对应的物质的性质或微粒结构如下:
①A的原子M层上有6个电子;
②B2+与D﹣具有相同的电子层结构,且可以相互组合形成常见干燥剂;
③元素C的单质常温为双原子气体分子,其氢化物水溶液呈碱性;
④元素D的最高正化合价为+7价.请回答下列问题:
(1)B的离子与D的离子相互组合形成的干燥剂的化学式是 .
(2)元素C与氢元素形成带一个单位正电荷的离子,为10电子微粒,写出该微粒的电子式(用元素符号表示) .
(3)元素A与元素D相比,非金属性较强的是(用元素符号表示),下列表述中能
证明这一事实的是 .
a.常温下A的单质和D的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D单质能从A的氢化物水溶液中置换出A单质
d.HD的酸性比HA酸性强.
【答案】
(1)CaCl2
(2)![]()
(3)Cl;bc
【解析】解:现有1﹣20号元素,A原子M层上有6个,则A是S元素;D元素最高正价是+7价,属于第VIIA族元素,且原子序数小于20,F元素没有正化合价,所以D是Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,氯化钙能作干燥剂,所以B是Ca元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,则C是N元素,(1)B的离子与D的离子相互组合形成的干燥剂CaCl2 , 所以答案是:CaCl2;(2)元素C与氢元素形成带一个单位正电荷的离子,该离子是NH4+离子,其电子式为: ![]() ,所以答案是:
,所以答案是: ![]() ;(3)同一周期元素,元素的非金属性随着原子序数的增大而增大,所以氯元素非金属性大于硫,a.单质的状态,属于物理性质,不能比较非金属性强弱,故a错误;b.Cl元素非金属性比S强,故HCl比硫化氢稳定,故b正确;c.一定条件下氯气能从硫化氢水溶液中置换出S单质,说明氯元素非金属性比S强,故c正确;d.氢化物溶液酸性强弱不能说明元素非金属性强弱,若非金属性F>Cl,但酸性HF<HCl,故d错误.
;(3)同一周期元素,元素的非金属性随着原子序数的增大而增大,所以氯元素非金属性大于硫,a.单质的状态,属于物理性质,不能比较非金属性强弱,故a错误;b.Cl元素非金属性比S强,故HCl比硫化氢稳定,故b正确;c.一定条件下氯气能从硫化氢水溶液中置换出S单质,说明氯元素非金属性比S强,故c正确;d.氢化物溶液酸性强弱不能说明元素非金属性强弱,若非金属性F>Cl,但酸性HF<HCl,故d错误.
所以答案是:Cl;bc.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】如图是一套制取并验证氯气部分化学性质的实验装置。
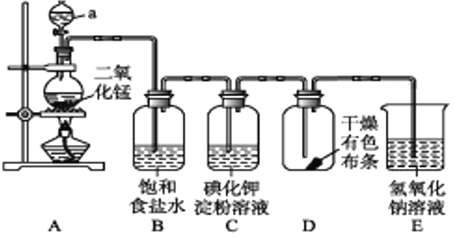
回答下列问题:
(1)装置A中,仪器a的名称叫____,该仪器中盛放的试剂为______;
(2)装置B的作用是__________________________________;
(3)当有少量Cl2通过后,观察到装置C中溶液颜色变成________色;
(4)当Cl2持续通过时,装置D中干燥的有色布条能否褪色?为什么? ________________;(5)若要证明Cl2无漂白性,则必须在装置D之前加一个装有_______的洗气瓶;
(6)装置E的作用是________,该反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,M,N,Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示,下列说法正确的是( ) 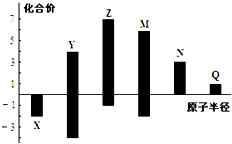
A.金属性:N>Q
B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X
D.原子序数:Z>M>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸甲酯A(C10H10O2)是一种用于辅助胃肠道痉挛及溃疡的药物,其合成路线如下图所示:
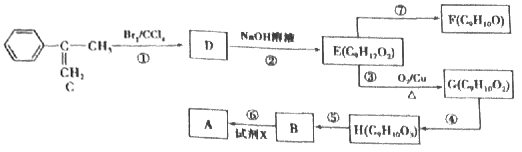
请回答下列问题:
(1)试剂X是甲醇,则B的名称是_____,B中含有的官能团的名称为_______。
(2)写出反应②的化学方程式:____________。
(3)C的分子式为_____,写出C的最简单同系物的名称______。G的结构简式为___________。
(4)A的同分异构体中,能使溴的四氯化碳溶液褪色、能水解、能发生银镜反应、含有苯环且只有一个取代基的同分异构体有______种。写出其中核磁共振氢谱吸收峰最多的一种______(写结构简式)。
(5)写出以甲基丙烯(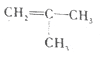 )为原料制备甲基丙烯酸(
)为原料制备甲基丙烯酸(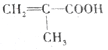 )路线图(无机试剂任选):_____________。
)路线图(无机试剂任选):_____________。
合成反应流程图表示方法示例如下:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品保鲜膜的材质有聚乙烯、聚氯乙烯等种类。下列叙述错误的是
A.等质量的聚乙烯和乙烯完全燃烧消耗氧气的量相等
B.聚氯乙烯薄膜放入试管中加强热可产生酸性气体,故不宜装熟食
C.聚氯乙烯的单体可由聚乙烯的单体与氯化氢加成制得
D.废弃的聚乙烯和聚氯乙烯均可回收利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列说法正确的是( )
①常温下,强酸溶液的pH=a,将溶液的体积稀释到原来10n倍,则pH=a+n
②已知BaSO4的Ksp=c(Ba2+)·c(SO42-),所以在BaSO4溶液中有![]()
③物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) =2c(H+) + c(CH3COOH)
④在0.1 mol/l氨水中滴加0.1 mol/l盐酸,刚好完全中和时pH=a,则由水电离产生的c(OH-)=10-amol·L-1
A. ①④ B. ②③ C. ③④ D. ①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列有关仪器的使用,能实现的是_______________(填序号)
A.用托盘天平称取11.70g食盐
B.用量筒量取12.36mL盐酸
C.用酸式滴定管量取21.20mL 0.10mol/L H2SO4溶液
D.用200mL容量瓶配制500mL 0.1mol/L NaCl溶液
Ⅱ.现用物质的量浓度为a mol/L的标准盐酸去测定V mL NaOH溶液的物质的量浓度,请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
(2)下图是酸式滴定管中液面在滴定前后的读数:则C (NaOH) = ______________。

(3)若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏______。
III. 我们知道空气中含有N2、O2、CO2、H2S等气体。试判断下列滴定操作的终点、分析下列现象的原因,并写出有关离子方程式。
(1)以酚酞为指示剂,用碱液滴定酸液到___________________________为终点。约半分钟后导致褪色的原因:________________________________________________。
(2)以淀粉为指示剂,用Na2S2O3滴定I2(2S2O32-+I2=S4O62-+2I-)到 __________________为终点,约5min后溶液又显色的原因: _________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com