
 a Z(g)+W(g)△H=-Q kJ?mol-1(Q>0)
a Z(g)+W(g)△H=-Q kJ?mol-1(Q>0)| c(Z)?c(W1) |
| c2(X)?c(Y) |
| c(Z)?c(W1) |
| c2(X)?c(Y) |
| Q1 |
| Q |
| Q1 |
| Q |
| Q1 |
| Q |
| Q1 |
| Q |
| c(Z)?c(W1) |
| c2(X)?c(Y) |
| c(Z)?c(W1) |
| c2(X)?c(Y) |
 Z(g)+W(g)△H=-Q kJ?mol-1(Q>0)
Z(g)+W(g)△H=-Q kJ?mol-1(Q>0)| 2x |
| 2 |
| Q1 |
| Q |
| Q1 |
| Q |
| (1-x)mol |
| 1L |
| Q1 |
| Q |
| Q1 |
| Q |
| Q1 |
| Q |


科目:高中化学 来源: 题型:
(2011?陕西一模)下列实验操作正确且能达到预期目的是( )
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑ Al(OH)3+3H+,Cu2++2H2O
Al(OH)3+3H+,Cu2++2H2O Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑
Cu(OH)2+2H+,2Al+6H+=2Al3++3H2↑| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 正极 | NaOH | Al-3e-=Al3+ | 2H2O+2e-=2OH-+H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Cu-2e--=Cu2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |
| D | 负极 | 稀硝酸 | Cu-2e-=Cu2+ | 2NO3-+8H+=2NO↑+4H2O+6e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
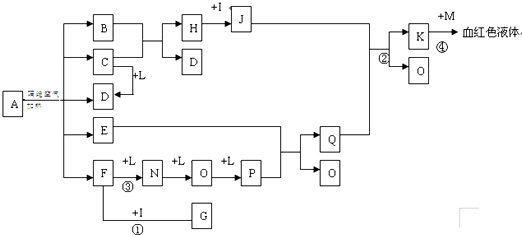
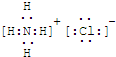
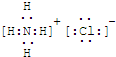
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com