
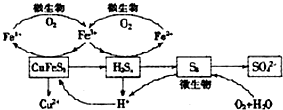
分析 (1)①双氧水将黄铜矿(CuFeS2)氧化得到硫酸根和三价铁;
②H2O2受热分解,Cu2+、Fe3+是H2O2分解的催化剂;
(2)增大一种反应物的浓度,可提高另一种反应物的转化率;
(3)向amol.L-l的氨水中缓慢加入等体积0.02mol.L-l的NH4C1溶液,平衡时溶液呈中性,则c(NH4+)=c(Cl-)=0.01mol/L,根据Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$计算;
(4)由图知Fe2(SO4)3、H2SO4是中间产物;在微生物作用下,氧气把亚铁离子氧化为铁离子;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,根据得失电子守恒计算.
解答 解:(1)①双氧水将黄铜矿氧化得到硫酸根和三价铁,离子方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O,故答案为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
②H2O2受热易分解,产物Cu2+、Fe3+催化H2O2分解,故答案为:H2O2受热分解;产物Cu2+、Fe3+催化H2O2分解等;
(2)增大一种反应物的浓度,可提高另一种反应物的转化率,可提高氨水的浓度、提高氧压,
故答案为:提高氨水的浓度、提高氧压;
(3)在25℃下,氨水微弱电离,浓度约为0.5a,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,则c(NH4+)=c(Cl-)=0.01mol/L,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-}).c(N{{H}_{4}}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-7}×0.01}{0.5a}$=$\frac{2×1{0}^{-9}}{a}$;铵根能与氢氧根结合,促进水的电离,则水的电离平衡向正方向移动;
故答案为:$\frac{2×1{0}^{-9}}{a}$;正向;
(4)由图知Fe2(SO4)3、H2SO4是中间产物,可循环使用,离子反应方程式为4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O,
故答案为:Fe2(SO4)3、H2SO4;4Fe2++O2+4H+$\frac{\underline{\;微生物\;}}{\;}$4Fe3++2H2O;
(5)铁元素最终全部转化为Fe3+,硫元素转化为硫酸根,当有2mol SO42-生成时,失去电子工17mol,消耗O2的物质的量为$\frac{17}{4}$mol=4.25mol,
故答案为:4.25 mol.
点评 本题考查物质的分离提纯、电离常数的计算以及氧化还原反应的计算等知识,侧重考查基本理论及计算能力,题目难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有18列,即18个族 | |
| B. | 目前使用的元素周期表中,最长的周期含有32种元素 | |
| C. | 短周期元素是指1~20号元素 | |
| D. | 原子的种类和元素的种类一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氘(D)原子核外有2个电子 | B. | 1H与D互称同位素 | ||
| C. | H2与D2互称同素异形体 | D. | 18g D2O的物质的量为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
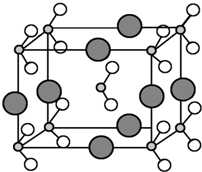 原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.
原子序数依次增大的A、B、C、D、E、F六种元素.其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
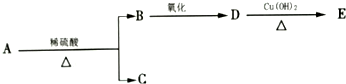 分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )
分子式为C9H18O2的有机物A有下列转化关系:其中B、C的相对分子质量相等,则A的可能的结构简式有( )| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
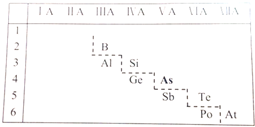
 ;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.
;砷蒸气的分子式:As4,其分子结构与白磷(P4)相似,也是正四面体,则As4中砷砷键的键角是60°.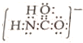 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com