
分析 (1)由于反应I和反应II中FeS2的量相等,所以可设FeS2的物质的量为12mol,所以反应Ⅰ中转移电子的物质的量为32×4mol,反应Ⅱ转移电子的物质的量为33×4mol;
(2)如果亚铁变质生成铁离子与碘离子反应生成紫黑色固体碘,由此书写离子反应方程;
(3)用氯化铁溶液腐蚀印刷电路板,生成氯化亚铁和氯化铜,而在滤渣中加入稀盐酸,产生气泡,说明氯化铁与铁反应,铁过量,所以铜离子反应完全;
(4)参加反应的铁粉为与铁离子反应及与氢离子反应的两部分之和,根据氢气的体积计算出与盐酸反应的铁的物质的量及HCl的物质的量,再根据氯原子守恒,求出氯化铁的物质的量,进而求出与铁离子反应的铁的物质的量.
解答 解:(1)由于反应I和反应II中FeS2的量相等,所以可设FeS2的物质的量为12mol,所以反应Ⅰ中转移电子的物质的量为32×4mol,反应Ⅱ转移电子的物质的量为33×4mol,故答案为:32:33;
(2)如果亚铁变质生成铁离子与碘离子反应生成紫黑色固体碘,所以离子反应方程2Fe3++2I-=2Fe2++I2,故答案为:2Fe3++2I-=2Fe2++I2;
(3)用氯化铁溶液腐蚀印刷电路板,生成氯化亚铁和氯化铜,而在滤渣中加入稀盐酸,产生气泡,说明氯化铁与铁反应,铁过量,所以铜离子反应完全,最后滤液中的金属离子主要是Fe2+,故答案为:Fe2+;
(4)氢气的物质的量为 $\frac{2.24L}{22.4L/mol}$=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
反应后的溶液不能使KSCN溶液变红色,所以所得溶液为氯化亚铁溶液,根据氯原子守恒,反应溶液中氯化铁的物质的量为$\frac{1}{2}$×0.2L×5mol/L=0.5mol,由氢守恒可知四氧化三铁的物的量为:$\frac{1-0.1×2}{8}$=0.1mol:与盐酸反应生成氯化铁的物质的量为0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
点评 本题考查了金属单质及其化合物性质的综合应用、离子方程式的书写及有关方程式的计算,题目难度中等,明确金属单质及其化合物的物质的性质及发生的反应是解题关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 用100 mL容量瓶配制90mL1mol/L的NaOH溶液 | |
| C. | 用量筒量取5.65mL的浓硫酸 | |
| D. | 用托盘天平准确称取3.2gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 纯净物 | 混合物 | 碱性氧化物 | 非电解质 |
| A | 液氯 | 漂白粉 | Al2O3 | CO |
| B | 醋酸 | 浓硫酸 | Na2O2 | 乙醇 |
| C | 碱石灰 | 盐酸 | K2O | Cl2 |
| D | 胆矾 | 水玻璃 | CaO | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 选用100mL容量瓶,并用蒸馏水洗净后烘干 | |
| B. | 称取5.9g NaCl固体倒入容量瓶中溶解 | |
| C. | 定容时俯视刻度会导致浓度偏高 | |
| D. | 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶体滴管加水至与刻度线相平即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 向油脂皂化反应后的溶液中滴入酚酞,溶液变红 | 油脂已经完全皂化 |
| B | 蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,有光亮的银生成 | 蔗糖溶液已经水解完全 |
| C | 向溶液X中滴入NaHCO3溶液,产生无色气体 | X中的溶质一定是酸 |
| D | 向鸡蛋清溶液中滴加醋酸铅溶液,产生白色沉淀,加水沉淀不消失 | 蛋白质发生了变性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
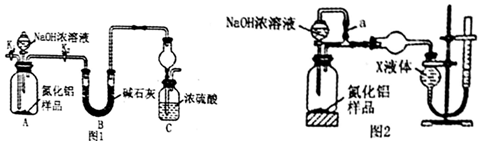
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯是一种用途广泛的有机原料,可制备多种化工产品.
乙苯是一种用途广泛的有机原料,可制备多种化工产品. +Cl2(g)$\stackrel{催化剂}{?}$
+Cl2(g)$\stackrel{催化剂}{?}$ -CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:
-CH(g)+HCl(g)△H>0,T℃时,向一恒压密闭容器中充入等物质的量的乙苯气体和氯气发生上述反应(已排除其他反应干扰),测得乙苯物质的量分数随时间变化如表所示:| 时间/(min) | 0 | 2 | 5 | 6 | 9 | 10 |
| χ(乙苯) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$ =CH2(g)+H2(g)△H=+124kJ/mol
=CH2(g)+H2(g)△H=+124kJ/mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com