
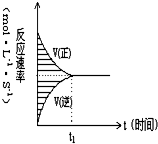
 在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )
在容积固定的4L密闭容器中,进行可逆反应X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如右图,如图中阴影部分面积表示( )| A. | X的浓度的减少 | B. | Y的物质的量的减少 | ||
| C. | Y的浓度的减少 | D. | X的物质的量的减少 |
科目:高中化学 来源: 题型:选择题

| A. | 装置出口①处的物质是氯气 | |
| B. | 出口②处的物质是氢气,该离子交换膜只能让阳离子通过 | |
| C. | 装置中发生的反应的离子方程式2Cl-+2H+$\stackrel{通电}{→}$Cl2↑+H2↑ | |
| D. | 该装置是将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6
④C2H4⑤CH2═CH-CH═CH2⑥C3H6 ⑧
⑧
| A. | ④和⑧ | B. | ①、②和③ | C. | ⑤和⑦ | D. | ④、⑥和⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X3Y | C. | X2 | D. | Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com