
【题目】下列过程中发生氧化还原反应的是( )
A. Cu和稀HNO3反应 B. Fe的导电
C. Na2CO3溶液与盐酸反应 D. CaCO3高温分解
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】在航天飞机返回地球大气层时,为防止其与空气剧烈摩擦而被烧毁,需在航天飞机外表面安装保护层。该保护层的材料可能为
A. 铝合金 B. 合金钢 C. 新型陶瓷 D. 塑料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氢键的说法正确的是
A.氢键是一种比较弱的化学键
B.HF的稳定性很强,是因为其分子间能形成氢键
C.乙醇分子与水分子之间形成氢键,使乙醇能与水任意比互溶
D.碘化氢的沸点比氯化氢的沸点高是因为碘化氢分子之间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的基本操作中,正确的是( )
A.用同一个滴管取用不同的药品
B.将实验中剩余的药品放回原试剂瓶
C.实验前对实验装置进行气密性检查
D.将实验室制备的可燃性气体直接点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品。
(1)海水中制得的氯化钠可用于生产烧碱及氯气。反应的离子方程式是 。
![]()
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
将Br2与Na2CO3反应的化学方程式补充完整:
![]()
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+、Mn2+等离子。以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):

生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH) 2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 。
② 用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 。
③ 步骤③需在HCl保护气中加热进行,请用化学平衡移动原理解释原因____________。
④ NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质。除去0.1mol CO(NH2)2时消耗NaClO g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
A.c(H+)= c(CH3COO-)+ c(OH-)
B.加入少量CH3COONa固体后,c(CH3COO-)降低
C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L
D.与等体积pH =11的NaOH溶液混合后溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )
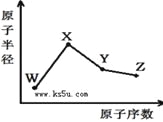
A. 最高化合价X>Y>Z>W
B. 气态氢化物的稳定性Z>Y>W
C. Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应
D. X、Z、W三种元素形成的化合物一定既含离子键又含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: .
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①写出该反应的热化学方程式: .
②随温度升高,该反应化学平衡常数的变化趋势是 (填增大、减小或不变)。
(3)在汽车尾气系统中装置催化转化器,可有效降低NO的排放。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: .
(4)通过NOx传感器可监测NOx的含量,其工作原理示意图如下:

①Pt电极上发生的是 反应(填“氧化”或“还原”)。
②写出NiO电极的电极反应式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+2B2(g)![]() 2AB2(g)△H <0,下列说法正确的( )
2AB2(g)△H <0,下列说法正确的( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com