
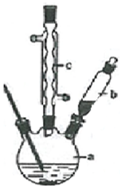
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: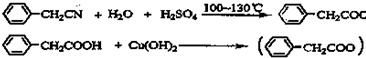
分析 (1)配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅;
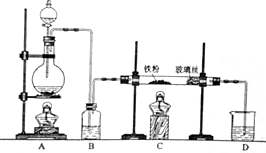
(2)由图可知,c为冷凝管,使气化的液体冷凝回流,仪器b可加入反应液;反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度;分离苯乙酸粗品,利用过滤操作;
(3)苯乙酸微溶于冷水,在水中的溶解度较小;由反应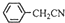 +H2O+H2SO4 $\stackrel{100-130℃}{→}$
+H2O+H2SO4 $\stackrel{100-130℃}{→}$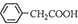 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
(4)用蒸馏水洗涤沉淀,将氯离子洗涤干净,利用硝酸银检验洗涤液确定是否洗涤干净;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度.
解答 解:(1)稀释浓硫酸放出大量的热,配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅,则加入蒸馏水与浓硫酸的先后顺序是先加水、再加入浓硫酸,
故答案为:先加水、再加入浓硫酸;
(2)由图可知,c为球形冷凝管,其作用为回流(或使气化的反应液冷凝),仪器b的作用为滴加苯乙腈;反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒,
故答案为:滴加苯乙腈;球形冷凝管;回流(或使气化的反应液冷凝);便于苯乙酸析出;BCE;
(3)苯乙酸微溶于冷水,在水中的溶解度较小,则提纯苯乙酸的方法是重结晶;由反应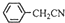 +H2O+H2SO4 $\stackrel{100-130℃}{→}$
+H2O+H2SO4 $\stackrel{100-130℃}{→}$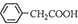 +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44g}{46.5g}$×100%=95%,
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是$\frac{44g}{46.5g}$×100%=95%,
故答案为:重结晶;95%;
(4)用蒸馏水洗涤沉淀,将氯离子洗涤干净,利用硝酸银检验洗涤液确定是否洗涤干净,则沉淀洗干净的实验操作和现象是取最后一次少量洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现,
故答案为:取最后一次少量洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,即混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应,故答案为:增大苯乙酸溶解度,便于充分反应.
点评 本题为2014年广西高考化学试题,侧重物质制备实验及有机物性质的考查,把握合成反应及实验装置的作用为解答的关键,综合考查学生实验技能和分析解答问题的能力,题目难度中等,注意信息的处理及应用.


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
某研究性学习小组模拟工业生产过程进行试验.请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T(K) | 938 | 1100 |
| K | 0.68 | 0.40 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨反应需使用催化剂,说明催化剂可以促进该平衡向生成氨的方向移动 | |
| B. | 常温下,用蒸馏水不断稀释醋酸,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值变小 | |
| C. | 反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | |
| D. | 对于Ca(OH)2的沉淀溶解平衡,升高温度,Ca(OH)2的溶解速率增大,Ksp减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中,9.6g 硫粉与 11.2g 铁粉混合加热生成硫化亚铁 17.6g 时,放出 19.12KJ 热量.则Fe(s)+S(s)═FeS(s)△H=-95.6KJ?mol-1 | |
| B. | 稀醋酸与 0.1mol?L-1NaOH 溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ?mol-1 | |
| C. | 已知,1molH2 完全燃烧生成液态水所放出的热量为 285.5KJ,则水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-285.5KJ?mol-1 | |
| D. | 已知 2C(s)+O2(g)═2CO(g)△H=-221KJ?mol-1,则可知 C 的燃烧热△H=-110.5KJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com