
【题目】将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法不正确的是
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法不正确的是
A.用物质B表示2s内的平均反应速率为0.15 mol/(L·s)
B.用物质A表示2 s内的平均反应速率为0.3 mol/(L·s)
C.2 s后物质B的浓度为0.35 mol/L
D.2 s后物质A的转化率为30%
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】我国是世界上最大的钨储藏国,金属钨可用于制造灯丝、合金钢和光学仪器,有“光明使者”的美誉;现以白钨矿(主要成分为CaWO4,还含有二氧化硅、氧化铁等杂质)为原料冶炼高纯度金属钨,工业流程如下:

已知:①钨酸酸性很弱,难溶于水;
②完全沉淀离子的pH值:SiO32-为8,WO42-为5;
③碳和金属钨在高温下会反应生成碳化钨。
回答下列问题:
(1)工业上生产纯碱常先制得碳酸氢钠,此法叫“联碱法”,为我国化工专家侯德榜创立,即向饱和食盐水中先通入NH3,再通入CO2,最终生成碳酸氢钠晶体和氯化铵溶液,写出该化学反应方程式:____________。
(2)流程中白钨矿CaWO4和纯碱发生的化学反应方程式是:________________________。
(3)滤渣B的主要成分是(写化学式)______。调节pH可选用的试剂是:_____(填选项)。
A.氨水 B.盐酸 C.NaOH溶液 D.Na2CO3溶液
(4)检验沉淀C是否洗涤干净的操作是________________________________________。
(5)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂的原因是_________。
(6)将氢氧化钙加入钨酸钠碱性溶液中可得到钨酸钙,已知某温度时,Ksp(CaWO4)=1×10-10,Ksp[Ca(OH)2]=4×10-7,当溶液中WO42-恰好沉淀完全(离子浓度等于10-5mol/L)时,溶液中c(OH-)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,利用冶铅废料(含有Pb、PbO、PbS、PbCO3、Pb(OH)2、C以及Fe及其氧化物等)制取立德粉(ZnS·BaSO4)和再提取铅的工艺流程如下:
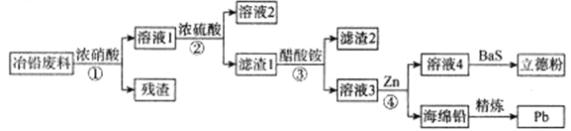
已知:
①醋酸铅易溶于水,难电离。
②常温下,Ksp(PbSO4)=1.6×10-8;Ksp(PbCO3)=8.0×10-14。
回答下列问题:
(1)为了加快①的反应速率,通常选用6mol/L的硝酸和60℃的反应条件,若温度继续升高,反而不利于反应的进行,原因可能是___________。
(2)步骤④若在实验室进行分离操作必需的玻璃仪器有___________,滤渣1的主要成分是硫酸铅,洗涤硫酸铅最好选用___________。
A.蒸馏水 B.苯 C.稀硫酸 D.饱和碳酸钠
(3)写出步骤③反应的离子方程式___________。
(4)采用电解法精炼铅,海绵铅连接电源的___________极(填正、负),生成铅的电极反应式为___________。
(5)处理含铅废料1t(含铅以PbO计,质量分数为11.15%),若回收率为90%,则得到的铅质量___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右表为元素周期表前四周期的一部分,下列有关W、X、Y、Z、R五种元素的叙述中,正确的是( )
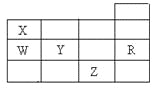
A. 常温下,Z单质为气态物质
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物的稳定性要比X的氢化物的稳定性强
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A. NH4Cl+NaOH=NaCl+NH3![]() +H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3
+H2O B. Mg3N2+6H2O=3Mg(OH)2+2NH3![]()
C. Cl2+2NaOH=NaClO+NaCl+H2O D. 2Na2O2+2H2O=NaOH+O2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)燃料电池是一种高效、环境友好的发电装置。氢氧燃料电池已用于航天飞机。以氢氧化钾溶液为电解质溶液的这种电池的负极反应式为_______________,这种电池在放电使用一段时间后,电解质溶液中的c(OHˉ)将___________(填“增大”“减小” 或“不变”)。
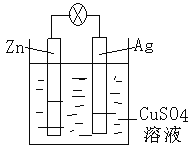
(2)如图是银锌原电池装置的示意图,以硫酸铜为电解质溶液。回答下列问题:锌为_______极,该电极上发生_________反应(“氧化”或“还原”),电极反应式为__________,该原电池的总反应离子方程式为__________________________________。
Ⅱ.一定温度下将6mol的A及6molB混合于2L的密闭容器中,发生如下反:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36mol/(L·min)。求:
(1)平衡时D的浓度=________。
(2)B的平均反应速率v(B)=____________。
(3)x=________________。
(4)开始时容器中的压强与平衡时的压强之比为_______(化为最简整数比)。
(5)以NH3代替氢气研发燃料电池是当前科研的一个热点。使用的电解质溶液是2mol·L-1的KOH溶液,电池总反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应__________;每消耗3.4gNH3转移的电子数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )

A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.24g镁在足量空气中充分燃烧时转移电子数大于![]()
B.![]() 氯气溶于足量NaOH溶液,转移的电子数为
氯气溶于足量NaOH溶液,转移的电子数为![]()
C.标准状况下,![]() 中含有的原子数目为
中含有的原子数目为![]()
D.常温常压下,![]() 和
和![]() 的混合气体中含有的原子数为
的混合气体中含有的原子数为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com