
| n |
| V |


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 一定温度下,某容积恒定的密闭容器中发生如下可逆反应:
一定温度下,某容积恒定的密闭容器中发生如下可逆反应:| A、起始时刻和t1达到平衡后气体的物质的量之比为5:4 |
| B、平衡后若加入少量碳,平衡向逆反应方向移动 |
| C、平衡后若加入氢气,上述反应的△H会增大 |
| D、t2时改变的条件可能是升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可能三种气体都存在 |
| B、可能只有氢气 |
| C、可能是甲烷和一氧化碳的混合气体 |
| D、可能只有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
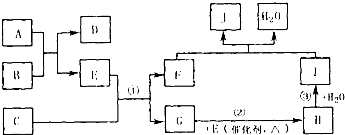
 已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):
已知M是由X、Y两种位于同周期的元素组成的离子化合物,且X+与氖原子具有相同的电子层结构,Y元素的最高正价与它的负价代数和为6.M与相关物质的转化关系如图(部分产物已略去):查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫在过量的氧气中燃烧生成三氧化硫 |
| B、氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C、氨气溶于水显碱性,可以用湿润的红色石蕊试纸检验氨气的生成 |
| D、Mg可由电解熔融的MgCl2制取,Al也可由电解熔融AlCl3制取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com