
| A. | 常温下,将pH=2的HA溶液与pH=12的BOH溶液等体积混合后,溶液的pH<7,则BA为强酸弱碱盐 | |
| B. | 弱电解质溶液稀释后,溶液中各离子浓度一定都减小 | |
| C. | 常温下,向体积相同pH均为1的盐酸和醋酸溶液中分别加入足量锌片,两种溶液生成H2的体积相同 | |
| D. | 常温下,将pH均为13的NaOH溶液和氨水分别加水稀释100倍后,氨水的碱性强于NaOH溶液 |
分析 A.常温下,将pH=2的HA溶液中氢离子浓度为10-2mol/L,pH=12的BOH溶液中氢氧根离子浓度为10-2mol/L,等体积混合后溶液的pH<7,溶液显酸性;
B.弱电解质平衡状态下的微粒浓度稀释减小,溶液中存在离子积常数分析判断氢离子浓度和氢氧根离子浓度变化;
C.常温下,向体积相同pH均为1的盐酸和醋酸溶液,醋酸溶液浓度大于盐酸;
D.一水合氨溶液中存在电离平衡,稀释促进电离.
解答 解:A.常温下,将pH=2的HA溶液中氢离子浓度为10-2mol/L,pH=12的BOH溶液中氢氧根离子浓度为10-2mol/L,等体积混合后溶液的pH<7,溶液显酸性,说明酸的浓度大于碱,酸一定是弱酸,但碱不能确定强弱,生成的盐可能是弱酸强碱盐或弱酸弱碱盐,故A错误;
B.弱电解质平衡状态下的微粒浓度稀释减小,溶液中存在离子积常数,若为弱酸溶液稀释,氢离子浓度减小,氢氧根离子浓度增大,故B错误;
C.常温下,向体积相同pH均为1的盐酸和醋酸溶液,醋酸溶液浓度大于盐酸,向体积相同pH均为1的盐酸和醋酸溶液中分别加入足量锌片,醋酸溶液生成氢气多,故C错误;
D.将pH均为13的NaOH溶液和氨水分别加水稀释100倍后,一水合氨又电离出氢氧根离子,氨水的碱性强于NaOH溶液,故D正确;
故选D.
点评 本题考查了酸碱反应后溶液酸碱性的判断、盐类水解原理、弱电解质电离平衡的影响因素,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| B. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| C. | 用氢氧焰可以加热软化玻璃制玻璃器皿,这利用了氢气和氧气化合时放出的热量 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
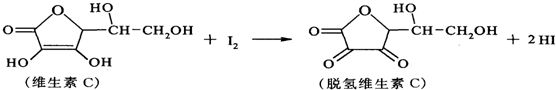
| A. | 上述反应为氧化还原反应 | |
| B. | 维生素C分子中有3种官能团 | |
| C. | 脱氢维生素C不能与氢气发生加成反应 | |
| D. | 脱氢维生素C的分子式为C6H6O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
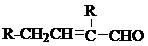
 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、 (其中两种).
(其中两种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.
第ⅤA族的氮、磷、砷(As)等元素在化合物中常表现出多种氧化态,含第ⅤA族元素的化合物在研究和生产中有许多重要用途.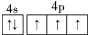 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰 | B. | 还原铁粉 | C. | 氯化钙 | D. | 硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2中含有的阴离子数为2NA | |
| B. | 标准状况下,由H2O2制得2.24LO2转移的电子数目为0.4NA | |
| C. | 常温常压下,8g O3含有4 NA个电子 | |
| D. | 常温下,1L pH=2的H2SO4溶液中含有的H+数目为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com