
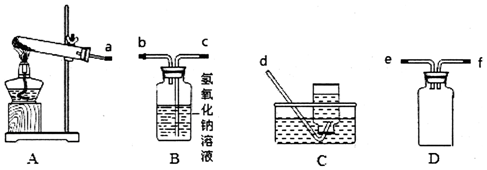
分析 (1)装置A是加热硝酸银的发生装置,生成的气体需要通过溶液,所以在通过溶液前需要防止倒吸,通过装置D为安全瓶,通过装置B吸收生成的二氧化氮气体,通过装置C收集生成的氧气,给固体加热试管口应略向下倾斜,防止生成的水蒸气冷凝倒流炸裂试管;
(2)加热时放出红棕色气体,当反应结束后,试管中残留固体为黑色,可能为单质银或氧化银;
(3)带火星的木条遇到氧气会复燃,分解生成的二氧化氮和氧气若按照4:1全部溶于水反应生成硝酸,硝酸和氢氧化钠溶液反应;
(4)利用0.1mol•L-1AgNO3溶液和同浓度、同体积的0.1mol/LNaCl溶液和NaI溶液反应观察出现现象判断,阴阳离子比相同难溶物可以利用沉淀快慢比较溶度积常数.
解答 解:(1)装置A是加热硝酸银的发生装置,生成的气体需要通过溶液,所以在通过溶液前需要防止倒吸,通过装置D为安全瓶,通过装置B吸收生成的二氧化氮气体,通过装置C收集生成的氧气,按照气流方向连接装置的接口顺序为aefcbd,装置A试管口稍微向下倾斜的原因是防止固体表面吸附的水气化后再试管口冷凝倒流炸裂试管,装置D是安全瓶作用是防止液体倒吸,
故答案为:a;e;f;c;b;d;防止固体表面吸附的水气化后再试管口冷凝倒流炸裂试管;防止倒吸;
(2)加热时放出红棕色气体,装置A加热AgNO3固体,产生红棕色气体为二氧化氮,当反应结束后,试管中残留固体为黑色,可能为单质银或氧化银,银不能溶解于氨水溶液,Ag2O能溶于氨水中形成银氨溶液,可以验证固体成分的判断,加入足量氨水,振荡黑色固体不溶解,说明生成的固体为Ag,硝酸与Ag反应生成NO气体,有气体生成说明固体中含有Ag,硫酸能溶解氧化银,金属银不与硫酸反应,可以验证固体成分,所以鉴别黑色固体不能选择的试剂是氢氧化钠,
故答案为:a;
(3)带火星的木条遇到氧气会复燃,当装置中的空气排尽时,收集产生的气体,并用带火星的木条检验.若能收集到O2,则现象为木条复燃,若不能收集到O2,则现象为木条不复燃,因为分解生成的二氧化氮和氧气若按照4:1全部溶于水反应生成硝酸,硝酸和氢氧化钠溶液反应,反应的化学方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,
故答案为:①;②;4NO2+O2+4NaOH=4NaNO3+2H2O;
(4)利用0.1mol•L-1AgNO3溶液和同浓度、同体积的0.1mol/LNaCl溶液和NaI溶液,先分别取5ml0.1mol/LNaCl溶液和NaI溶液充分混合,然后逐滴滴入0.1mol/LAgNO3溶液,若先析出黄色沉淀,则Ksp(AgCl)>Ksp(AgI),若先析出白色沉淀则Ksp(AgCl)<Ksp(AgI),
故答案为:先分别取5ml0.1mol/LNaCl溶液和NaI溶液充分混合,然后逐滴滴入0.1mol/LAgNO3溶液,若先析出黄色沉淀,则Ksp(AgCl)>Ksp(AgI),若先析出白色沉淀则Ksp(AgCl)<Ksp(AgI).
点评 本题考查了实验设计的方法和物质实验验证方案分析判断,物质性质的应用是解题关键,题目难度中等,侧重于考查学生的对基础知识的应用能力和计算能力.


科目:高中化学 来源: 题型:实验题
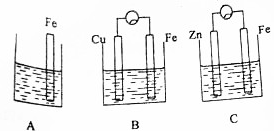 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮是重要的非金属元素,可以形成多种化合物.回答以下问题:
氮是重要的非金属元素,可以形成多种化合物.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小 | |
| B. | 酸碱中和滴定时,若未用待测液润洗锥形瓶,对测定结果无影响 | |
| C. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| D. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤洗涤并收集沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤⑥ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸分子的结构式:H-Cl-O | B. | 硫离子的结构示意  | ||
| C. | 质量数为37的氯原子为:37Cl | D. | 二氧化硅的分子式为:SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔、沸点依次升高 | |
| B. | 在NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | CO2、SO2都是极性分子 | |
| D. | 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com