
| A. | 6 | B. | 5 | C. | 4 | D. | 2 |
分析 能与NaHCO3反应生成CO2,说明其分子中含有-COOH,C10H12O2的不饱和度为$\frac{10×2+2-12}{2}$=5,苯环和羧基的不饱和度为5,则其它结构都是链状单键,然后结合苯环上有1个取代基判断其可能结构.
解答 解:分子式为C10H12O2,能与NaHCO3反应生成气体,说明该有机物中一定含有羧基:-COOH,根据分子组成可知,该有机物除了苯环和羧基以外,其它都是单键,另外还含有:10-6-1=3个C,苯环上有一个取代基,则相当于用-COOH和苯环取代”-CH2-CH2-CH2-“上的H原子,
如图: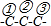 ,取代同一C上的H原子有2种:①(或③)、②,取代不同C上的H原子有2种:①②、①③和②③,
,取代同一C上的H原子有2种:①(或③)、②,取代不同C上的H原子有2种:①②、①③和②③,
所以满足条件的有机物的结构简式总共有2+3=5种,
故选C.
点评 本题考查了有机物同分异构体的求算,题目难度中等,注意掌握同分异构体的概念及求算方法,正确根据题干信息判断出该有机物分子含有的官能团、取代基类型为解答本题关键.


科目:高中化学 来源: 题型:选择题
| A. | 配平后水的化学计量数为4 | |
| B. | 反应后溶液呈酸性 | |
| C. | 配平后氧化剂与还原剂的物质的量之比为3:28 | |
| D. | 氧化产物为AsO43-和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度均为0.01 mol•L-1的醋酸和硫酸溶液中分别加入足量锌片,生成H2的起始速率相等 | |
| B. | 0.1 mol•L-1的NaHCO3溶液中:[Na+]=[HCO3-]+[CO32-]+[H2CO3] | |
| C. | pH=11的氨水与pH=3的盐酸等体积混合:[Cl-]=[NH4+]>[OH-]=[H+] | |
| D. | 将0.1 mol的CH3COOH和0.1 mol的CH3COONa溶于水中,配成1L混合溶液.测得溶液的pH<7,则混合液中[CH3COO-]<[Na+] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 产生${\;}_{30}^{65}$Zn的反应是聚变反应 | |
| B. | ${\;}_{30}^{64}$Zn和${\;}_{30}^{65}$Zn具有相同的质子数 | |
| C. | ${\;}_{30}^{65}$Zn衰变放射出γ射线时,发生质量亏损,质量亏损并不意味着质量被消灭 | |
| D. | γ射线在真空中传播的速度是3.0×108m/s | |
| E. | γ射线是由于锌原子的内层电子激发产生的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
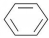 +HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$
+HNO3(浓)$\frac{\underline{\;\;\;浓硫酸\;\;\;}}{50~60℃}$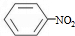 +H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:
+H2O设计一个实验制取一定量的纯净硝基苯.有关信息见下表:| 物质 | 熔点/℃ | 沸点/℃ | 相对密度/(20℃) | 毒性 | 水溶性 |
| 苯 | 5.5 | 80.1 | 0.8794 | 有 | 不溶于水 |
| 硝酸 | -41.59 | 83 | 1.503 | - | 易溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 有 | 不溶于水 |
| 硫酸 | 10.0 | 338 | 1.84 | - | 易溶于水 |

| 1 | 用蒸馏水洗涤反应混合液,分液后取下层液体 |
| 2 | |
| 3 | |
| 4 | |
| 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | Z和Y组成的物质是原子晶体 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com