
| A. | NH4+、K+、CO32-、Cl- | B. | Al3+、Cu2+、S2-、Cl- | ||
| C. | NH4+、Cu2+、Cl-、NO3- | D. | Fe3+、K+、SCN-、NO3- |
分析 由水电离出的c(H+)=1×10-12的溶液,为酸或碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能结合生成络离子等,则离子大量共存,以此来解答.
解答 解:A.酸性溶液中不能大量存在CO32-,碱溶液中不能大量存在NH4+,故A不选;
B.碱性溶液中不能大量存在Al3+、Cu2+,酸性溶液中不能大量存在S2-,且Al3+与S2-相互促进水解,Cu2+与S2-结合生成沉淀,不能共存,故B不选;
C.酸性溶液中该组离子之间不反应,可大量共存,故C选;
D.Fe3+、SCN-结合生成络离子,碱溶液中不能大量存在Fe3+,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:实验题
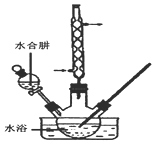 碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.
碘化钠是一种白色结晶粉末,医疗上可用于甲状腺肿瘤防治剂、祛痰剂等.实验室用NaOH、单质碘和水合肼为原料制得,部分装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热等于57.3kJ | |
| B. | 在一密闭容器中发生反应2SO2+O2?2SO3,增大压强,平衡正向移动,K增大 | |
| C. | 2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C的燃烧热△H=-110.5 kJ•mol-1 | |
| D. | 向稀硫酸中加入少量硫酸铜可提高锌与稀硫酸反应生成氢气的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量Al3+的无色溶液中:Ca2+、Na+、Cl-、HCO3- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在强酸的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Ca2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中可以显酸性的物质是酸 | |
| B. | 电离时产生的阳离子中有H+的化合物是酸 | |
| C. | 电离时产生的阴离子全部是OH-的化合物是碱 | |
| D. | 盐只能电离出金属阳离子和酸根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
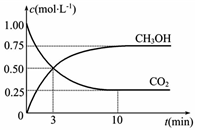 “低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
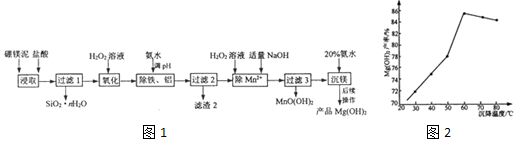
| pH值 | Mg(OH)2 | Mn(OH)2 | MnO(OH)2 | Fe(OH)2 | Al(OH)3 | Fe(OH)3 |
| 开始沉淀时 | 9.3 | 7.1 | 7.8 | 7.6 | 3.7 | 2.3 |
| 沉淀完全时 | 10.8 | 10.8 | 9.8 | 9.6 | 4.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com