
【题目】根据反应 MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________.
②氧化剂是________,氧化产物是________.
③在标准状况下有44、8L Cl2生成时,被氧化的物质是________mol
科目:高中化学 来源: 题型:
【题目】化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时: ![]() =
= ![]()
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.MnS(s)的浊液中加入少量可溶性MnSO4固体后,c(S2﹣)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
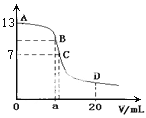
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2NA
C.NO2和H2O反应每生成2molHNO3时转移的电子数目为2NA
D.lmolFe在氧气中充分燃烧失去3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
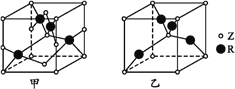
【题目】已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____,其基态原子有__种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____。
(3)与XYZ-互为等电子体微粒的化学式为______(写出一种即可),XYZ-的中心原子的杂化方式为_____。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__。
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__,乙的化学式为__;高温时,甲易转化为乙的原因为_____________。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______g·cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜~锌原电池,电解质溶液为稀硫酸,当该原电池工作时( )
A.铜电极上发生氧化反应
B.铜电极上发生还原反应
C.电子从铜极经过外电路流向锌极
D.电解质溶液中H+浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.分子式为C2H6O的有机化合物性质相同
B.相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能途径a:C ![]() CO+H2
CO+H2 ![]() CO2+H2O
CO2+H2O
途径b:C ![]() CO2
CO2
C. 可以表示乙醇分子的球棍模型
可以表示乙醇分子的球棍模型
D.![]() :既可以表示甲烷分子,也可以表示四氯化碳分子
:既可以表示甲烷分子,也可以表示四氯化碳分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com