
(10分)已知几种难溶电解质的溶度积如下表所示:
|
几种难溶电解质的Ksp(25℃) |
|
|
沉淀溶解平衡 |
Ksp |
|
AgBr(s) |
5,0×10-13mol2·L-2 |
|
AgI(s) |
8.3×10-17mol2·L-2 |
|
FeS(s) |
6.3×10-18mol2·L-2 |
|
ZnS(s) |
1.6×10-24mol2·L-2 |
|
CuS(s) |
1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则c(I-) (填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+) (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)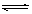 Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
科目:高中化学 来源: 题型:
已知几种难溶电解质的溶度积常数(25℃)见下表
|
查看答案和解析>>
科目:高中化学 来源: 题型:
已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) | |
| 沉淀溶解平衡 | Ksp |
|
| 5,0×10-13mol2·L-2 |
|
| 8.3×10-17mol2·L-2 |
|
| 6.3×10-18mol2·L-2 |
|
| 1.6×10-24mol2·L-2 |
|
| 1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺序为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则[I-] (填“增大”、“减小”或“不变”),若改加AgBr固体,则[Ag+] (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡:
ZnS(s) ![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是( )
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是( )
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) | |
| 沉淀溶解平衡 | Ksp |
| AgBr(s) | 5,0×10-13mol2·L-2 |
| AgI(s) | 8.3×10-17mol2·L-2 |
| FeS(s) | 6.3×10-18mol2·L-2 |
| ZnS(s) | 1.6×10-24mol2·L-2 |
| CuS(s) | 1.3×10-36mol2·L-2 |
(1)AgBr、AgI、FeS、ZnS、CuS的溶解能力由大到小的顺为: 。
(2)向饱和的AgI溶液中加入固体硝酸银,则c(I-) (填“增大”、“减小”或“不变”),若改加AgBr固体,则c(Ag+) (填“增大”、“减小”或“不变”)。
(3)在25℃时,向100mL浓度均为0.1 mol·L-1 FeCl2、ZnCl2、CuCl2的混合溶液中逐滴加入Na2S溶液,生成的沉淀的先后顺序是 (用沉淀物的化学式表示)。
(4)在25℃时,把ZnS加入蒸馏水中,一定时间后达到如下平衡: ZnS(s)![]() Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 。
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是 。
A.加入少量CuS固体 B.加入少量FeS固体
C.加入少量FeCl2固体 D.加入少量CuCl2固体
查看答案和解析>>
科目:高中化学 来源:2010年江西省新余九中高二上学期期中考试化学试卷 题型:填空题
已知几种难溶电解质的溶度积如下表所示:
| 几种难溶电解质的Ksp(25℃) | |
| 沉淀溶解平衡 | Ksp |
 AgBr(s) Ag+(aq)+Br-(aq) AgBr(s) Ag+(aq)+Br-(aq) | 5,0×10-13mol2·L-2 |
 AgI(s) Ag+(aq)+I-(aq) AgI(s) Ag+(aq)+I-(aq) | 8.3×10-17mol2·L-2 |
 FeS(s) Fe2+(aq)+S2-(aq) FeS(s) Fe2+(aq)+S2-(aq) | 6.3×10-18mol2·L-2 |
 ZnS(s) Zn2+(aq)+S2-(aq) ZnS(s) Zn2+(aq)+S2-(aq) | 1.6×10-24mol2·L-2 |
 CuS(s) Cu2+(aq)+S2-(aq) CuS(s) Cu2+(aq)+S2-(aq) | 1.3×10-36mol2·L-2 |
 Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是( )
Zn2+(aq)+S2-(aq),下列措施可使ZnS减少的是( )| A.加入少量CuS固体 | B.加入少量FeS固体 |
| C.加入少量FeCl2固体 | D.加入少量CuCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com