
 二氧化碳的回收利用是环保领域研究热点.
二氧化碳的回收利用是环保领域研究热点.
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
| CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
| CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
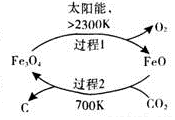
分析 (1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式;
(2)1mol甲醇完全燃烧生成稳定氧化物放出的热量为甲醇的燃烧热,①CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
②2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
③CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
根据盖斯定律,根据②×$\frac{3}{2}$-①-③计算CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H的焓变即可;
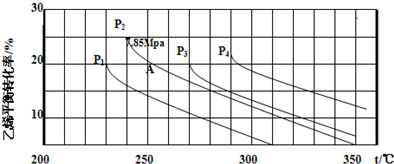
(3)①温度越高,二氧化碳的转化率降低,所以反应逆向进行,得到反应是放热的,温度升高,K减小;
②20~30min间各组分的浓度都增加,所以可能是缩小容器体积的结果,相当于增大压强,会引起平衡的移动,据此画出CH2=CH2的浓度随反应时间的变化情况曲线;
(4)根据影响产物产率的因素只能是引起平衡移动的因素,根据平衡移动原理来解释;
(5)根据Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$计算c(OH-),再计算pH.
解答 解:(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4,过程1中Fe3O4分解生成FeO和O2,所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2,
故答案为:CO2$\frac{\underline{\;太阳能\;}}{FeO}$C+O2;
(2)1mol甲醇完全燃烧生成稳定氧化物放出的热量为甲醇的燃烧热,①CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=-a kJ•mol-1;
②2H2(g)+O2(g)=2H2O(l)△H=-b kJ•mol-1;
③CH3OH(g)=CH3OH(l)△H=-c kJ•mol-1,
根据盖斯定律,②×$\frac{3}{2}$-①-③得到CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),所以反应的△H=(-$\frac{3b}{2}$+a+c)kJ/mol=a+c-1.5b kJ•mol-1,故答案为:a+c-1.5b kJ•mol-1;
(3)①温度越高,二氧化碳的转化率降低,所以反应逆向进行,得到反应是放热的,温度升高,K减小,即平衡常数KA>KB;故答案为:>;
②20~30min间各组分的浓度都增加,所以可能是缩小容器体积的结果,相当于增大压强,CH2=CH2的浓度随反应时间的变化情况曲线如下: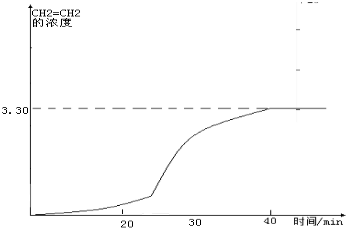 (在20-30分钟内曲线突然变陡),故答案为:D;
(在20-30分钟内曲线突然变陡),故答案为:D; (在20-30分钟内曲线突然变陡);
(在20-30分钟内曲线突然变陡);
(4)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,故选BD;
(5)根据Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Kw}{K2}$=$\frac{1{0}^{-14}}{5×1{0}^{-11}}$=2×10-4=$\frac{{c}^{2}(O{H}^{-})}{0.5}$,所以c(OH-)=10-2mol/L,pH=12.故答案为:12.
点评 本题综合考查学生盖斯定律的应用、化学平衡的移动以及水解常数的表达式及计算等,题目难度大,侧重于考查学生对基础知识的应用能力和应用能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 3mol•L-1 | C. | 2mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
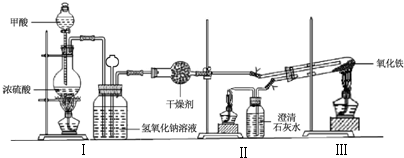
 用如图所示装置制取乙酸乙酯.请回答下列问题:
用如图所示装置制取乙酸乙酯.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
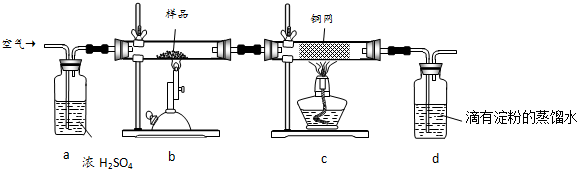
 已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):
已知某醇燃料含有碳、氢、氧三种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验结果(假设产生的气体完全被吸收):| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 过氧化钠和水反应:2O22-+2H2O=4OH-+O2↑ | |
| B. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| C. | 向氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 硫化钠水溶液呈碱性:S2-+H2O?HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 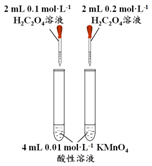 | 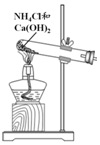 | 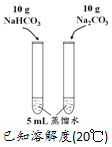 NaHCO3:9.6 g Na2CO3:21.8 g | 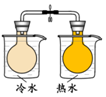 将NO2球浸泡在冷水和热水中 |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com