
 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH. 分析 装置为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,在碳极上氧气得电子生成OH-离子,铁被氧化生成Fe2+,以此解答该题.
解答 解:装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O═4OH-,滴加酚酞,溶液变红色,铁钉被氧化生成Fe2+,附近的溶液生成蓝色沉淀,反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,
故答案为:铁钉附近的溶液有蓝色沉淀;Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;O2+4e-+2H2O=4OH-.
点评 本题考查电化学知识,为高频考点,侧重于学生的分析能力的考查,题目难度中等,做题时注意电极的判断和电极反应的书写,以及离子的性质和检验.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
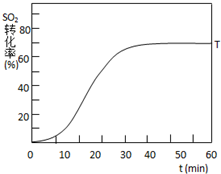 根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.
根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:
在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
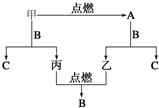 甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体,它们之间的转化关系如图所示.
甲、乙、丙三种常见单质,A、B、C是三种常见的化合物,A为淡黄色固体,它们之间的转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn为正极,Cu为负极,CuCl2溶液作电解质溶液 | |
| B. | Cu为正极,Zn为负极,稀H2SO4作电解质溶液 | |
| C. | Cu为正极,Zn为负极,CuSO4溶液作电解质溶液 | |
| D. | Fe为正极,Zn为负极,ZnSO4溶液作电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 氧化反应与化合反应属于并列关系 | B. | 单质与化合物属于交叉关系 | ||
| C. | 化合物与氧化物属于包含关系 | D. | 纯净物与混合物属于包含关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com