
| A、5 | B、4 | C、3 | D、2 |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |
| 2 |
| x |


科目:高中化学 来源: 题型:
 X、Y、Z是三种常见的物质,它们之间存在着如图的转化关系:
X、Y、Z是三种常见的物质,它们之间存在着如图的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、汽车尾气中的氮氧化物与光化学烟雾形成有关 |
| B、电解氯化铝溶液可获得金属铝 |
| C、大量燃烧含硫燃料是形成酸雨的主要原因 |
| D、铜具有良好的导电性,常用来制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0mol/L的KNO3溶液:H+,Fe2+,K+,SO42- |
| B、由水电离出 c(H+)=1.0×10-13的溶液:Na+,CH3COO-,HCO3-,SO42- |
| C、加入甲基橙试液呈红色的溶液:NH4+,K+,SO42-,Cl- |
| D、饱和氯水中:NO3-,Na+,SO32-,Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的燃烧热为571.6 kJ?mol-1 | ||||||
B、
| ||||||
| C、同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | ||||||
| D、3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①可用于验证Na与H2O反应是否放热 |
| B、装置②可用于比较Na2CO3与NaHCO3的稳定性 |
| C、装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D、装置④可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径大小:Z>Y>X>W |
| B、W、Y、Z中最简单氢化物稳定性最弱的是W |
| C、Z元素单质在化学反应中只表现氧化性 |
| D、z元素氧化物对应水化物的酸性一定强于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 活性炭 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、若完全燃烧,1mol雄酮(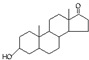 )比雌酮( )比雌酮( )多消耗3mol O2 )多消耗3mol O2 |
| B、正戊烷、异戊烷和新戊烷互为同分异构体,沸点依次升高 |
| C、蔗糖、麦芽糖和乳糖的分子式都为C12H22O11,均能发生银镜反应 |
| D、乙醇依次通过消去、取代、加成反应可生成乙二醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com