
分析 (1)碳酸钠是强碱弱酸盐,水解显碱性;NaHCO3水解溶液呈碱性,Al2(SO4)3在溶液中水解显酸性,二者混合发生相互促进的水解,生成二氧化碳和氢氧化铝;
(2)①酸(碱)越弱,则对应的盐的水解程度越大;
②CO32-的水解分两步,而HCO3-既能水解又能电离,据此分析离子种类;
③依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行;
(3)依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中根据离子积常数和(OH-):c(H+)=1012 计算溶液中的氢氧根离子浓度分析判断BOH是强碱还是弱碱;依据强电解质、弱电解质写出电离方程式;
(4)醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子溶液中离子积是常数分析;
(5)依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小;
(6)先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较PH,再按照溶液的PH由大到小进行排序;
(7)吸氧腐蚀中,正极氧气得到电子生成氢氧根离子.
解答 解:(1)碳酸钠是强碱弱酸盐,分步水解,水解离子方程式为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;
HCO3-水解,反应为:HCO3-+H2O

NaHCO3溶液跟Al2(SO4)3溶液混合,发生相互促进的水解:3HCO3-+Al3+=3CO2↑+Al(OH)3↓,产生大量的气体和沉淀.
故答案为:CO32-+H2O?HCO3-+OH-、HCO3-+H2O?H2CO3+OH-;3HCO3-+Al3+=3CO2↑+Al(OH)3↓;
(2)①CO32-对应的酸为HCO3-,而HCO3-对应的酸为H2CO3,由于酸性H2CO3>HCO3-,而酸越弱,盐越水解,故Na2CO3的水解程度大于NaHCO3的水解程度,即Na2CO3 溶液的碱性强于NaHCO3的碱性,则PH大小:Na2CO3>NaHCO3,故答案为:>;
②CO32-的水解分两步进行:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,故Na2CO3溶液中存在Na+、CO32-、HCO3-、H2CO3、OH-、H+、H2O,而HCO3-既能水解又能电离:HCO3-+H2O?H2CO3+OH-,HCO3-?H++CO32-,故故NaHCO3溶液中存在Na+、CO32-、HCO3-、H2CO3、OH-、H+、H2O,所以两种溶液中微粒种类相同,
故答案为:=;
③依据碳酸钠水解平衡分析,加入氢氧化钠增大氢氧根离子浓度,平衡左移,碳酸根离子浓度增大;碳酸氢钠溶液中加入氢氧化钠溶液,氢氧根离子和碳酸氢根离子电离出的氢离子反应.促进电离正向进行,碳酸氢根离子浓度减小,
故答案为:增大;减小;
(3)甲为0.1mol/L的HA溶液,pH>1,说明酸为完全电离,依据溶质浓度和溶液PH分析判断HA为弱酸,乙溶液中c(H+)c(OH-)=10-14,根据离子积常数和c(OH-):c(H+)=1012 计算溶液中的氢氧根离子浓度为:c(OH-)=10-13mol/L,分析判断BOH是弱碱;依据弱电解质存在电离平衡写出电离方程式为:HA?H++A-,BOH?B++OH-,故答案为:HA?H++A-;BOH?B++OH-;
(4)醋酸钠溶液中醋酸根离子水解生成醋酸和氢氧根离子,溶液中离子积是常数,所以醋酸钠溶液中微粒数减小,故答案为:>;
(5)依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小;
物质的量浓度相同的①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵五种溶液中,依据溶质浓度不考虑水解计算铵根浓度比较大小,然后再依据其他离子对铵根离子水解平衡的影响,弱电解质电离程度小,铵根离子水解程度小,c(NH4+)由大到小的顺序是:⑤>④>②>③>①,
故答案为:⑤>④>②>③>①.
(6)属于碱的为:③NaOH;
水解呈碱性的为:④CH3COONa,但由于水解程度较小,则pH:③>④;
溶液呈中性的为:⑤KCl;
溶液呈酸性的有:①②⑥,其中①为一元强酸,②为一元弱酸,⑥水解呈酸性,浓度相同时,
溶液的pH:⑥>②>①,综合以上分析可知,溶液的pH由大到小的顺序是为:①②⑥⑤④③,
故答案为:①②⑥⑤④③;
(7)钢铁发生吸氧腐蚀的正极氧气得到电子生成氢氧根离子,正确的反应式为:O2+2H2O+4e-═4OH-,故答案为:O2+2H2O+4e-═4OH-.
点评 本题考查了离子浓度的大小比较以及盐溶液水解程度大小判断,为高频考点,注意“越弱越水解”是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 把CO2通入CaCl2溶液中,有CaCO3沉淀生成 | |
| B. | 把SO2通入Ca(NO3)2溶液中,有CaSO3沉淀生成 | |
| C. | 把CO2通入Ca(ClO)2溶液中,有CaCO3沉淀生成,说明酸性:H2CO3>HClO | |
| D. | 把SO2通入Ca(ClO)2溶液中,有CaSO3沉淀生成,说明酸性:H2SO3>HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②③④ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
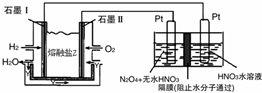 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/K | 298 | 398 | 498 | … |
| K/(mol•L-1)2 | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①④⑤ | C. | ③④⑤ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶.有气泡从溶液中冒出 | |
| B. | H2、I2、HI混合气体加压后颜色变深 | |
| C. | 实验室中常用排饱和食盐水的方法收集 | |
| D. | 合成氨工业采用高压条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.56g Na2O2含有的阴离子数为0.02NA | |
| B. | 标准状况下,22.4L SO3含有的分子数为NA | |
| C. | 0.1mol氯气参与反应,转移的电子数一定为0.2NA | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Clˉ个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为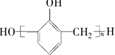 | |
| B. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出,但沉淀原理不同 | |
| C. | 醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 | |
| D. | 淀粉水解实验:淀粉溶液中加入稀硫酸加热水解得水解液,再加入NaOH溶液得中和液,后加入新制Cu(OH)2悬浊液加热后有红色沉淀.结论:淀粉已水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com