
除去下列物质中的杂质选用的试剂和方法最合理的是
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 二氧化硅 | 氧化铝 | 氢氧化钠溶液 | 过滤 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
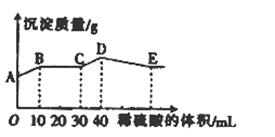
将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol•L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.BC段发生反应的离子方程式为:H++OH-=H2O
C.D点表示的沉淀的化学式为Al(OH)3、BaSO4
D.E点表示的溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氯水的下列叙述中,正确的是( )
A.新制氯水中只有Cl2和H2O两种分子
B.新制氯水可使蓝色石蕊试纸先变红后退色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水放置数天后,酸性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d中重合部分代表物质间反应,且氯水足量)。
Ⅰ.(1)能证明氯水具有漂白性的是________(填“a”、“b”、“c”或“d”)。
(2)c过程中的现象是_____________________________________________,
b过程中反应的化学方程式为______________________________。
(3)久置的氯水变为________,用化学反应方程式表示为_______________。
(4)实验室保存饱和氯水的方法是_________________________________。
Ⅱ.用滴管将新制的饱和氯水慢慢滴入含酚酞的NaOH稀溶液中。当滴到最后一滴时红色突然退去。试回答下列问题:
(1)是由于_________________________________________________;
(2)是由于________________________________________________。
简述怎样用实验证明红色退去的原因是(1)还是(2):
_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
 |
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBr b.加入NaBr溶液 c.加入Na2CO3溶液 d.加入Na2SO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键
B.sp3杂化轨道是由能量相近1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形
D.氨气分子中有一对未参与杂化的孤对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。
(1)基态Si原子中,电子占据的最高能层符号为____________。
(2)硅也有系列氢化物-----硅烷,SiH4分子中H原子的1s轨道与Si原子的__________轨道重叠形成Si—H σ键。
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,这种变化关系原因是
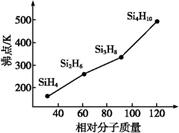
___________________________________________________________________________。
(4)科学家们在高温高压下将CO2制成与SiO2结构类似的新型CO2晶体。这种新型CO2晶体与SiO2相比,熔点更高的是____________________;原因是__________________
___________________________________________________________________________。
(5)在硅酸盐中,Si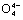 四面体[如下图(a)]通过共用顶角氧离子可形成多种结构型式。图(b)为一种无限长单链结构的多硅酸根X;
四面体[如下图(a)]通过共用顶角氧离子可形成多种结构型式。图(b)为一种无限长单链结构的多硅酸根X;
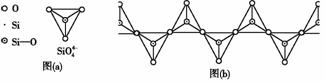
X中Si与O的原子数之比为________________,化学式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
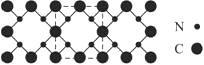
氮化碳结构如下图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是
A.氮化碳属于原子晶体
B.氮化碳中碳显—4价,氮显+3价
C.氮化碳的化学式为:C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com