
| A. | HCl、MgCl2 | B. | Na2O、CO2 | C. | CaCl2、CH4 | D. | NH3、H2O |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物中一定含有离子键,可能含有共价键,共价化合物中一定不含离子键,含有共价键.
解答 解:A.HCl为共价化合物,只含共价键;MgCl2为离子化合物,只含离子键,故A错误;
B.Na2O为离子化合物,只含离子键;CO2为共价化合物,只含共价键;所以三种物质所含化学键类型不完全相同,故B错误;
C.CaCl2为离子化合物,只含离子键,CH4为共价化合物,只含共价键,故C错误;
D.NH3、H2O两种物质都是共价化合物,含有的化学键都是共价键,所以化学键类型相同,故D正确.
故选D.
点评 本题考查了根据化合物判断化学键类型,为高频考点,难度不大,明确离子键和共价键的区别是解答本题的关键.


科目:高中化学 来源: 题型:解答题
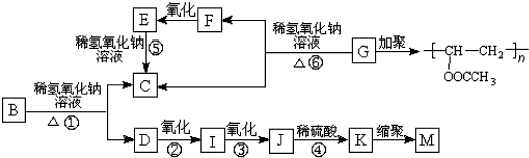
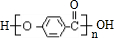 .
.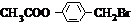 +3NaOH$→_{△}^{水}$CH3COONa+
+3NaOH$→_{△}^{水}$CH3COONa+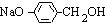 +NaBr+H2O,
+NaBr+H2O,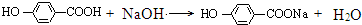 .
.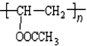 在氢氧化钠溶液中加热:
在氢氧化钠溶液中加热: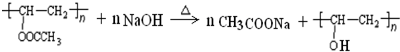 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠:Al+2OH-═AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中2Al+6H+═2Al3++3H2↑ | |
| D. | 铁跟稀盐酸反应:Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述弱酸溶液的pH=4 | |
| B. | 加入NaOH溶液后,弱酸的电离平衡向右移动,K值增大 | |
| C. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH=7 | |
| D. | 加入等体积0.01 mol•L-1 NaOH溶液后,所得溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
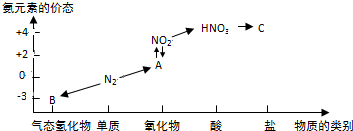
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
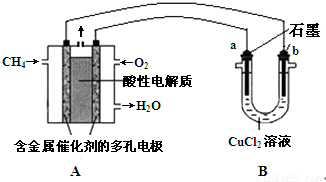
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①⑤ | C. | ①②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com