
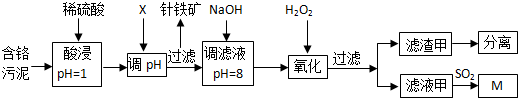
| 阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 9.3 | --- |
| 沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 11.1 | 9(>9溶解) |
| 10-14 |
| 10-a |
| Ksp |
| c2(OH-) |
| 2.2×10-20 |
| (10-14+a)2 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、该酸的水溶液中c(H+):c(XOnm-)=n:1 |
| B、该酸的摩尔质量为(m+a+16n)g |
| C、100mL该酸溶液,只能中和4gNaOH |
| D、若0.1molL-1该酸溶液的pH=1,则NamXOn的水溶液的pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14 | B、38 | C、57 | D、无定值 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5mol/L Na2S溶液中含Na+数目为5NA |
| B、1.00mol NaCl中,所有Na+的最外层电子总数为10NA |
| C、常温常压下,48gO2和O3混合气体中,含有氧原子数为3NA |
| D、标况下含NA个氮原子的N2和N2O的混合气体中,N2体积为5.6L |
查看答案和解析>>
科目:高中化学 来源: 题型:
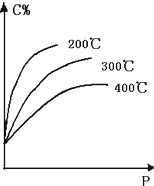 对于反应mA(s)+nB(g)?eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
对于反应mA(s)+nB(g)?eC(g)+f D(g),当其它条件不变,平衡时C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )| A、化学方程式中n<e+f |
| B、达到平衡后,加入催化剂,则C%增大 |
| C、达到平衡后,若升温,平衡逆向移动 |
| D、达到平衡后,增加A的量,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com