
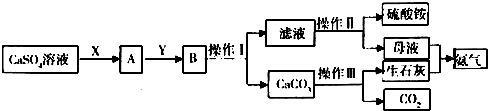

分析 硫酸钙溶液通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,与溶液中的氨水、硫酸钙溶液反应生成碳酸钙沉淀和硫酸铵溶液,经过过滤分离得到碳酸钙沉淀再煅烧生成生石灰,而旅游硫酸铵经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到硫酸铵晶体,
(1)从硫酸铵溶液中获得硫酸铵晶体,可以用降温结晶的方法,固体物质加热,把固体放在坩埚中;
(2)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的碱性溶液易和二氧化碳反应,能把CaSO4完全转化为CaCO3;
(3)根据实验室制备氨气的化学原理及实验操作的可行性、实验安全等进行分析判断;
(4)氨气与氧化铜在加热的条件下发生氧化还原反应,氨气被氧化成氮气或一氧化氮等,根据F处铜片没有任何变化、D中无明显现象、只观察到C中黑色粉末变红,可知,该反应的产物应为氮气和铜等,若实验过程中C中只观察到黑色粉末变红,F处铜片逐渐溶解,则产物为铜和一氧化氮,D中一氧化氮遇空气生成二氧化氮,F中二氧化氮遇水生成硝酸,硝酸能溶解铜,据此答题.
解答 解:硫酸钙悬浊液通入足量的氨气,使溶液成碱性,再通适量的二氧化碳,与溶液中的氨水、硫酸钙悬浊液反应生成碳酸钙沉淀和硫酸铵溶液,经过过滤分离得到碳酸钙沉淀再煅烧生成生石灰,而旅游硫酸铵经过蒸发浓缩、冷却结晶,过滤、洗涤、干燥得到硫酸铵晶体;
(1)由分析知:B为碳酸钙沉淀和硫酸铵溶液,分离二者的实验操作应为:过滤,滤液硫酸铵溶液,使硫酸铵在溶液中析出的方法为:先加热制成饱和溶液
(蒸发浓缩)再降温冷却,结晶析出(冷却结晶),过滤;酸钙为固体,高温加热或煅烧固体,应把固体放在坩埚中,故盛放碳酸钙所用的仪器是坩埚,
故答案为:冷却结晶;坩埚;
(2)中性条件下CO2的溶解度很小,但是氨气易溶于水,得到的碱性溶液易和二氧化碳反应,能把CaSO4完全转化为CaCO3,往CaSO4悬浊液中加入NH3后,发生反应如下:CaSO4+2NH3+2H2O?Ca(OH)2+(NH4)2SO4,向其中加入CO2可以生成CaCO3,平衡向正方向移动,有利于(NH4)2SO4的生成,则X为NH3,Y为CO2;根据反应流程得知:工艺流程中生成NH3和CO2,也需要使用NH3和CO2,可循环利用的物质的有NH3,CO2;
故答案为:NH3;CO2; NH3,CO2;
(3)甲:氯化铵受热分解成氨气和氯化氢,但氨气和氯化氢一冷却马上又可以化合成氯化铵,这个方案很难制氨气;
乙:氨水中存在平衡关系:NH3+H2O═NH3•H2O═NH4++OH-,加热浓氨水,氨气溶解度降低,从溶液中逸出,平衡向逆反应方向移动,可以制取氨气;
丙:熟石灰和氯化铵混合后加热可以制取氨气,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,可以制取氨气;
丁:利用CaO与H2O剧烈反应,生成Ca(OH)2,放出大量热,促进NH3•H2O的分解及NH3的挥发逸出,又由于Ca(OH)2是强碱,也促进NH3•H2O的分解及NH3的挥发逸出,反应的化学方程式为:NH3•H2O+CaO═NH3↑+Ca(OH)2,可以制取氨气,
故答案为:甲;
(4)氨气与氧化铜在加热的条件下发生氧化还原反应,氨气被氧化成氮气或一氧化氮等,根据F处铜片没有任何变化、D中无明显现象、只观察到C中黑色粉末变红,可知,该反应的产物应为氮气和铜等,反应的方程式为2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O,若实验过程中C中只观察到黑色粉末变红,F处铜片逐渐溶解,则产物为铜和一氧化氮,D中一氧化氮遇空气生成二氧化氮,F中二氧化氮遇水生成硝酸,硝酸能溶解铜,所以①D中观察到的现象是出现红棕色气体,②F中铜片逐渐溶解的原因是从E中出来的气体含有二氧化氮,二氧化氮与水反应生成硝酸使铜片溶解,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O;出现红棕色气体;从E中出来的气体含有二氧化氮,二氧化氮与水反应生成硝酸使铜片溶解.
点评 本题为工艺流程题,涉及原料、产品的判断、方程式的书写、检验、气体的制备等.做题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测、计算,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 正、逆反应速率都减小 | D. | 正、逆反应速率都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:
已知苯甲酸乙酯的沸点为213℃(在此温度以下水、乙醇和环己烷以7.0%、17.0%、76.0%的比例成为蒸汽逸出).请回答上述实验室制备苯甲酸乙酯的有关问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中含D物质的量至少为0.45 mol | |
| B. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| C. | 容器中A、B、C、D的物质的量之比一定是4:5:4:6 | |
| D. | 容器中A的物质的量一定增加了0.30 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:
某学校化学兴趣小组以在不同的温度下淀粉遇碘变蓝色的快慢为背景来研究温度对化学反应速率影响.具体研究过程:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com