
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.

| 化学平衡的影响因素;化学平衡状态的判断;化学平衡的计算.. | |
| 专题: | 化学平衡专题. |
| 分析: | (1)根据三段式结合题中数据进行计算; (2)根据图示中t2时的逆反应速率变化及影响化学反应速率的因素判断改变的条件; (3)根据达到平衡状态时,正逆反应速率相等,各组分的浓度不变进行判断. |
| 解答: | 解:(1)N2(g)+3H2(g)⇌2NH3(g) 起始量(mol) 2 3 0 转化量(mol)0.4 1.2 0.8 平衡量(mol)1.6 1.8 0.8 v(H2)= 平衡时,氮气的转化率= 故答案为:0.024mol•L﹣1•s﹣1;20%; (2)t2时,逆反应速率突然增大,原因可能是使用了催化剂、升高了温度、增大了压强、增大了氨的浓度,而后逆反应速率减小,平衡逆向移动,则只能是t2时增大了氨的浓度或升高了温度, 故答案为:升高了温度;增大了氨的浓度; (3)判断达到平衡的标准是“变化量不变”, A、恒温、恒压达到平衡下,容器乙中的气体密度不再变化,说明容器体积不再变化,可以说明反应达到平衡状态,故A正确; B、氨气的生成速率与氮气的消耗速率都是正反应速率,不能说明反应达到平衡状态,故B错误; C、断裂1molN≡N键同时断裂6molN﹣H键,即消耗1mol N2的同时消耗2mol NH3,说明正逆反应速率相等,说明反应达到平衡状态,故C正确; D、容器乙中气体的平均相对分子质量不随时间而变化,说明体系中各物质的体积分数不变,反应达到平衡状态,故D正确; 故选:ACD; |
| 点评: | 本题考查了化学平衡状态的判断、化学反应速率的计算等知识,题目难度中等,要求学生掌握化学平衡状态的判断方法、化学反应速率的计算方法. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某有机化合物的结构简式为: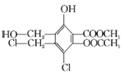 ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是
A. 1 mol该物质最多可以消耗3 mol Na
B.1 mol该物质最多可以消耗7 mol NaOH
C.不能与Na2CO3溶液反应
D.易溶于水,可以发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数的值,下列说法正确的是
NA个Fe(OH)3胶体粒子的质量为107g
B.标准状况下,将2.24 L SO2溶于水中,溶液中H2SO3分子的数目是0.1NA
C.4.6 gN2O4和NO2的混合气体中含有的氧原子数为0.2NA
D.在含有2molH2SO4的浓硫酸中加入足量Zn粉,反应后转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用于净化汽车尾气的反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g),已知该反应570K时平衡常数为1×1059,但反应速率极慢.下列说法正确的是( )
|
| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
|
| B. | 提高尾气净化效率的常用方法是升高温度 |
|
| C. | 增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
|
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于可逆反应N2(g)+3H2(g)⇌2NH3(g)△H<0,下列研究结果和示意图相符的是( )
| A | B | C | D | |
| 研究 结果 | 压强对反应的影响 | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
B.反应Hg(1)+H2SO4(aq) = HgSO4(aq)+H2(g)在常温下不能自发进行,则△H>0
C.将纯水加热至较高温度,K变大、pH变小、呈酸性
D.锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
查看答案和解析>>
科目:高中化学 来源: 题型:
将某些化学知识用数轴表示,具有直观形象、简明易记的优点。下列用数轴表示的化学知识中不正确的是( )
A.分散系的分类: 
B.AlCl3和NaOH溶液反应后铝元素的存在形式:
C.常温下甲基橙的变色范围: 
D.CO2与NaOH溶液反应的产物: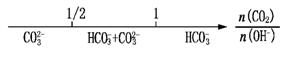
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸镍铵[(NH4) xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:
①准确称取2.335 0 g样品,配制成100.00 mL溶液A;
②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;
③另取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”“偏低”或“不变”)。
(2)氨气常用 检验,现象是
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com