
【题目】已知:
P4(白磷,s)+5O2(g)═P4O10(s)△H=﹣2983.2kJ/mol
P(红磷,s)+ ![]() O2(g)═
O2(g)═ ![]() P4O10(s)△H=﹣738.5kJ/mol
P4O10(s)△H=﹣738.5kJ/mol
试写出白磷转化为红磷的热化学方程式;白磷的稳定性比红磷(填“高”或“低”).
【答案】P4(白磷,s)=4 P(红磷,s)△H=﹣29.2 kJ/mol;低
【解析】解:P4(s,白磷)+5O2(g)=P4O10(s)△H1=﹣2983.2kJ/mol…①
P(s,红磷)+ ![]() O2(g)=
O2(g)= ![]() P4O10(s)△H2=﹣738.5kJ/mol…②
P4O10(s)△H2=﹣738.5kJ/mol…②
根据盖斯定律:①﹣②×4可得:P4(s,白磷)=4P(s,红磷)△H=(﹣2983.2kJ/mol)﹣(﹣738.5kJ)×4=﹣29.2kJ/mol,
说明白磷转化为红磷是放热反应,相同的状况下,能量比白磷低,而能量越低,物质越稳定,故白磷稳定性低于红磷,
所以答案是:P4(白磷,s)=4 P(红磷,s)△H=﹣29.2 kJ/mol;低.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】《唐本草》和《本草图经》中记载:“绛矾,本来绿色,……正如瑁璃烧之赤色”“取此物(绛矾)置于铁板上,聚炭,……吹令火炽,其矾即沸,流出,色赤如融金汁者是真也”。其中不涉及的物质是( )
A.FeSO4·7H2OB.SC.Fe2O3D.H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Na2O2吸收 CO2 产生 O2,可用作呼吸面具供氧剂
B.ClO2 具有还原性,可用于自来水的杀菌消毒
C.碘化钾可用作加碘食盐的添加剂
D.镁是优质的耐高温材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,可用废镍催化剂(主要含Ni、Al,少量Cr、FeS等)来制备,其工艺流程如图: 
回答下列问题:
(1)“浸泡除铝”时,发生反应的化学方程式为 .
(2)“溶解”时放出的气体为(填化学式).
(3)“氧化1”时,酸性条件下,溶液中的Fe2+被氧化为Fe3+ , 其离子方程式为 .
(4)已知该条件下金属离子开始沉淀和完全沉淀的pH如表:
开始沉淀的pH | 完全沉淀的pH | |
Ni2+ | 6.2 | 8.6 |
Fe2+ | 7.6 | 9.1 |
Fe3+ | 2.3 | 3.3 |
Cr2+ | 4.5 | 5.6 |
“调pH1“时,溶液pH范围为;过滤2所得滤渣的成分为 .
(5)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式 .
(6)若加热不充分,则制得的NiOOH会混有Ni(OH)2 , 其组成可表示为xNiOOHyNi(OH)2 . 现称取8.29gxNiOOHyNi(OH)2样品溶于稀硫酸,搅拌至溶液清亮,定容至200mL,从中移取20.00mL,用0.010molL﹣1的,KMnO4标准溶液滴定,重复上述操作2次,平均消耗KMnO4标准溶液20.00mL.已知5Ni2++MnO4﹣+8H+═5Ni2++Mn2++4H2O,则x= , y= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,(![]() )X位于立方体的顶点,(○)Y位于立方体的中心,试分析:
)X位于立方体的顶点,(○)Y位于立方体的中心,试分析:

(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX=________(填角的度数)。
(4)若该立方体的棱长为a cm,晶体密度为ρ g·cm-3,NA为阿伏加德罗常数,则该离子化合物的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是( )
A.碳酸钡可用于检查肠胃的内服药剂
B.漂白粉可用于生活用水的消毒
C.在食盐中添加适量的KIO3来预防碘缺乏症
D.碳酸钠可用于去除餐具的油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
A.图1表示相同温度下,相同体积、pH均为1的盐酸和醋酸溶液分别加水稀释时溶液pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.图2表示CH3COOH溶液中逐步加CH3COONa固体后,溶液pH的变化
C.图3表示某可逆反应正、逆反应速率随温度变化,则该反应的正反应是吸热反应
D.图4表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)N2O4(g),相同时间后测得NO2体积分数的曲线,则该反应的正反应△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某外毒素为环状肽,结构式如图所示,据图回答问题:
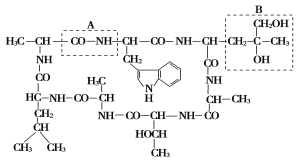
(1)该化合物中含有 个游离的氨基, 个游离的羧基。
(2)组成该化合物的氨基酸有 种,其中重复出现的R基是 。
(3)该化合物含有 个肽键。
(4)B框所示的R基所构成的氨基酸的相对分子质量是 。
(5)该外毒素在环状肽形成过程中失去了 个水分子,相对分子质量减少了 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸是一种酸性极强的无机含氧酸,可用于制备高氯酸盐、人造金刚石提纯等方面.查阅资料得到以下有关高氯酸的信息:
名称 | 分子式 | 外观 | 沸点 |
高氯酸 | HClO4 | 无色液体 | 130℃ |
工业上生产高氯酸的同时还生产了亚氯酸钠,工业流程如图: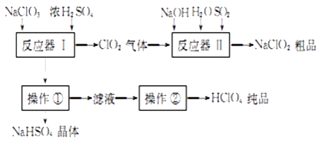
(1)操作①的名称是 , 操作②的名称是 .
(2)反应器Ⅰ中发生反应的化学方程式为 .
(3)反应器Ⅱ中发生反应的离子方程式为 .
(4)若反应器Ⅱ中SO2以H2O2代替也可达到同样的目,此时发生反应的离子方程式为 .
(5)若想得到201 kg的 HClO4纯品,至少需要NaClO3 kg.
(6)工业上也可用铂作阳极、铜作阴极电解盐酸制得高氯酸,在阳极区可得到20%的高氯酸.写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com