
【题目】下列各组元素性质或原子结构的递变,叙述不正确的是( )
A. Na、Mg、Al原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次增大
C. N、O、F得电子能力依次减弱
D. LiOH、NaOH、KOH的碱性逐渐增强
科目:高中化学 来源: 题型:
【题目】从结构的角度可以帮助我们更好的理解有机物的化学性质。
(1) 乙炔是一种重要的化工原料,将乙炔通入[Cu(NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____________。乙炔与氢氰酸反应可得丙烯腈H2C=CH-C≡N。丙烯腈分子中碳原子轨道杂化类型是____________。[Cu(NH3)2]Cl的氨水溶液在空气中放置迅速由无色变为深蓝色,写出该过程的离子方程式______________________。
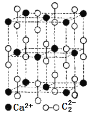
(2)实验室制乙炔使用的电石主要含有碳化钙,写出碳化钙的电子式______________, CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中有哑铃形![]() 的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的
的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的![]() 数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
数目为____________。已知CaC2晶体的密度为2.22g/cm3,该晶胞的体积为____________cm3
(3) 甲醇催化氧化可得到甲醛,甲醛分子中的键角大约为____________,甲醇的沸点比甲醛的高,其主要原因是_____________________。
(4)已知苯酚具有弱酸性,其Ka=1.1 ×10-10;水杨酸第一级电离形成的离子为![]() 判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
判断相同温度下电离平衡常数Ka2(水杨酸)_______Ka(苯酚)(填“>”或“<”),其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

①配制一定物质的量浓度的硬脂酸的苯溶液;
②测定从胶头滴管滴出的每滴液体的体积;
③测定在水槽水面上形成硬脂酸单分子膜所需硬脂酸苯溶液的滴数,(如上图所示)用胶头滴管
吸取硬脂酸的苯溶液,垂直往水面中滴一滴,待苯在水面上全部挥发,硬脂酸分子在水面扩散至看不到油珠时,再滴第二滴,如此逐滴滴下,直到整个水面形成单个分子厚的硬脂酸分子所形成的膜为止(该单分子膜分子是紧密排列的,此时如再滴入硬脂酸溶液,该溶液在水面上不再扩散);
④测量水槽中水的表面积;
⑤计算求得阿伏加德罗常数。
(1)在第一步实验中,称取一定质量的硬脂酸后,配制溶液所需的玻璃仪器主要有 、 、 。
(2)第二步实验,测定从胶头滴管滴出的每滴液体的体积,常用方法是
(3)若硬脂酸苯溶液的浓度为c molL-1,测得胶头滴管滴出的每滴溶液的体积为V mL,水面上形成硬脂酸单分子膜时滴下的硬脂酸溶液的滴数为d,水槽中水的表面积为S cm2,每个硬脂酸分子的截面积为A cm2。求阿伏加德罗常数NA(用c、V、d、S、A的代数式表示): 。
(4)若水中含有少量氢氧化钠溶液,则会对测定的NA值有何影响? (选填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,饱和NaClO溶液的pH约为11。某消毒液的主要成分为NaClO,洁厕灵主要成分为HCl。下列解释相关事实的离子方程式中不合理的是
A.该消毒液加白醋生成HClO,可增强消毒能力:H++ClO-=HClO
B.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH-=ClO-+Cl-+H2O
C.常温下,该消毒液的pH≈11,是因为:ClO-+H2O![]() HClO+OH-
HClO+OH-
D.该消毒液与洁厕灵混用会引起中毒:2H++Cl-+ClO-=Cl2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,H2O2在水溶液中发生分解反应:2H2O2 ![]() 2H2O + O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O + O2↑反应过程中,测得不同时间H2O2的物质的量浓度如下表:
![]()
(1)H2O2的分解反应__氧化还原反应(填“是”或“不是”)。要加快该反应的速率,可采取的方法有 。
(2)该分解反应0─20min的平均反应速率v(H2O2)为 mol·L-1 min-1。
(3)如果反应所用的H2O2溶液为100mL,则共产生O2 g。
A.0.08 B.0.16 C.1.2 D.2.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L容器中X、Y、Z三种物质的量随时间的变化曲线如图所示。由图中数据分析,

(1)达到平衡时,Y的浓度为_________________
(2)反应开始至2min,Z的平均反应速率为_____________
(3)该反应的化学方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是用途广泛的金属,但在生产过程中易产生有害的含铬工业废水。
I、还原沉淀法是处理含Cr2O42— 和CrO72—工业废水的一种常用方法,其工艺流程如下:
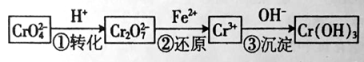
其中第①步存在平衡:2CrO42—(黄色)+2H+![]() Cr2O72— (橙色)+H2O
Cr2O72— (橙色)+H2O
(1)若平衡体系中,pH=0时溶液显 色。
(2)以石墨为电极,电解Na2CrO4制备Na2Cr2O7的装置如图所示。
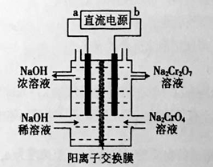
a极的名称是 ;b极直接相连一极的反应式为 。
(3)第②步反应的离子方程式: 。
第②步反应后的溶液加入一定量烧碱,若溶液中c(Fe3+)=2.0×10—12mol·L—1,则溶液中c(Cr3+)= mol·L—1。(已知Ksp[Fe(OH)3]=4.0×10—38 mol·L—1,Ksp[Cr(OH)3]=6.0x10—31 mol·L—1)。
II、探究CrO3的强氧化性和热稳定性
(4)CrO3遇有机物(如酒精)时猛烈反应以至着火。若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的Cr2(SO4)3。补充并配平下列反应式:
aCrO3+bC2H5OH+cH2SO4=dCr2(SO4)3+eCH3COOH+fR
b:c:f= 。
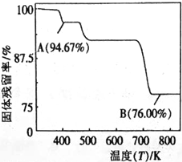
(5)CrO3的热稳定性差,加热时逐步分解,其固定残留率随温度的变化如图所示。B点时生成固体的化学式为 。(固体残留率= ![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式______________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物的化学式分别是________,其中最不稳定的是________。
(3)它们的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的化学式________,电子式________,结构式________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给你提供纯锌、纯铜片和500 mL 0.4 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。

(1)如图所示,装置气密性良好,且1 000 mL量筒中已充满了水,则开始实验时,首先要______。
(2)a电极材料为________,其电极反应式为______________。b电极材料为________,其电极反应式为______________。
(3) 当量筒中收集672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com