
����Ŀ���о����ʵ��۽ṹ�������������������ʱ仯�ı��ʡ�
��1��N��Al��Si��Zn����Ԫ���У���һ��Ԫ�صĵ������������£�
������ | I1 | I2 | I3 | I4 | I5 | ���� |
Im/kJ��mol��1 | 578 | 1817 | 2745 | 11575 | 14830 | ���� |
���Ԫ����______(��Ԫ�ط���)��
��2����Ԫ�ؿ����γ������������������������й㷺��Ӧ�á�
��ά����B4�ṹ��ͼ��ʾ����̼ԭ�ӵĹ���ӻ�������_________��1 molά����B4�����к��ЦҼ�����ĿΪ________��
��NF3�Ŀռ乹��Ϊ______(����������)����NF3���ӻ�Ϊ�ȵ������������Ϊ______(�ѧʽ)��
��3������Ԫ�س���H2O��NH3��CN����SCN�����γ�����
��C��N��O����Ԫ�صĵ縺���ɴ�С��˳��Ϊ________��
��X��Y��Ϊ��������Ԫ�ء�X��̬ԭ�ӵ��ڲ���ȫ���������ӣ�������������Ϊ1��Y��̬ԭ����ͬ����Ԫ����δ�ɶԵ�������࣬��X����̬��������Ų�ʽ________��Ԫ��Y�����ڱ���λ�ڵ�________�塣
����������[Fe(SCN)]2+�У��ṩ�չ������________��[Zn(CN)4]2-��Zn2+��CN����Cԭ���γ���λ������[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ________��
���𰸡� Al sp2 16 mol ������ SO![]() ��ClO O��N��C 1s22s22p63s23p63d10 �� [Ar]3d10 ��B Fe3+
��ClO O��N��C 1s22s22p63s23p63d10 �� [Ar]3d10 ��B Fe3+ 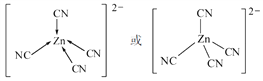
����������1������Ԫ�ص�����֪�����������ܺ͵��ĵ��������ϴ�˵����Ԫ��ԭ��ʧȥ3������ʱ��Ϊ�ȶ��ṹ���������Ԫ��ԭ���������3�����ӣ�N��Al��Si��Zn����Ԫ�ص�ԭ����ֻ��Alԭ���������3�����ӣ����Ԫ����Al����2����ά����B4�ṹ��ͼ��ʾ����̼ԭ�Ӿ��γ�һ��˫��������ӻ�������sp2��˫������1���Ҽ���1��![]() ��������1 molά����B4�����к��ЦҼ�����ĿΪ16 mol����NF3��Nԭ�ӵļ۲���Ӷ���=3+
��������1 molά����B4�����к��ЦҼ�����ĿΪ16 mol����NF3��Nԭ�ӵļ۲���Ӷ���=3+![]() =4����һ���µ��Ӷԣ����Է��ӵĿռ乹���������Σ�ͬ����Ԫ�ؼ۵�������ͬ������NF3���ӻ�Ϊ�ȵ������������ΪSO
=4����һ���µ��Ӷԣ����Է��ӵĿռ乹���������Σ�ͬ����Ԫ�ؼ۵�������ͬ������NF3���ӻ�Ϊ�ȵ������������ΪSO![]() ��ClO����3����Ԫ��ԭ�ӵĵõ�������Խǿ����縺��Խ������O>N>C����Ԫ��X λ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ����ڲ������=2+8+18=28��������������Ϊ1�����Ը�ԭ����29�����ӣ�ΪCuԪ�أ�Ԫ��YΪ��������Ԫ�أ���̬ԭ����ͬ����Ԫ����δ�ɶԵ�������࣬�����Ų�ʽΪ3d54s1����Y��CrԪ�أ���X����̬��������Ų�ʽ1s22s22p63s23p63d10 �� [Ar]3d10��Ԫ��Y��Cr,�����ڱ���λ�ڵڢ�B�壻����������[Fe(SCN)]2+�У�����������ṩ�µ��Ӷԣ����������������ṩ�չ�����ʴ�Ϊ��Fe3+��[Zn(CN)4]2-��Zn2+��CN����Cԭ���γ���λ������[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ
��ClO����3����Ԫ��ԭ�ӵĵõ�������Խǿ����縺��Խ������O>N>C����Ԫ��X λ�ڵ������ڣ����̬ԭ�ӵ��ڲ���ȫ���������ӣ����ڲ������=2+8+18=28��������������Ϊ1�����Ը�ԭ����29�����ӣ�ΪCuԪ�أ�Ԫ��YΪ��������Ԫ�أ���̬ԭ����ͬ����Ԫ����δ�ɶԵ�������࣬�����Ų�ʽΪ3d54s1����Y��CrԪ�أ���X����̬��������Ų�ʽ1s22s22p63s23p63d10 �� [Ar]3d10��Ԫ��Y��Cr,�����ڱ���λ�ڵڢ�B�壻����������[Fe(SCN)]2+�У�����������ṩ�µ��Ӷԣ����������������ṩ�չ�����ʴ�Ϊ��Fe3+��[Zn(CN)4]2-��Zn2+��CN����Cԭ���γ���λ������[Zn(CN)4]2-�Ľṹ����ʾ��ͼ��ʾΪ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�������ﵽĿ�ĵ���
A. ���ѻ�������ȡ��ˮ�еĵ�
B. ��ˮ���𱽡����Ȼ�̼���Ҵ�������ɫҺ��
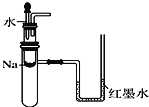
C. ����ͼװ����֤Na��ˮ��Ӧ�Ƿ�Ϊ���ȷ�Ӧ
D. ������KMnO4��Һ�м����Ҵ�����֤�Ҵ��Ļ�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӭ�ӡ���ɫУ���������У�С��ͬѧ������г��飬���ɲ��ɵ��ǣ� ��
A.�ᳫ��ɫ����
B.�ᳫʹ������ϴ�Ӽ�
C.�ᳫʹ��һ�������ϴ�
D.�ᳫ��������ͻ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ҽѧ��֤ʵ�����۸�����(Cr3+)�ǹ����������������ӵ���Ҫ��ɲ��֣��ܹ���ǿ�ȵ��ص����á������������������Ӻ͵����ʵ�Ԫ����C��H��O��N��S��Cr�ȡ�
��1��Cr�ļ۲�����Ų�ʽΪ__________________��
��2��O��N��S��Cr�ĵ�һ�������ɴ�С��˳��Ϊ___________________��
��3��SO2���ӵ�VSEPRģ�͵�����Ϊ_________��SO32-��������ԭ�ӵ��ӻ���ʽΪ_________��
��4��CO2�������幹�͵�����Ϊ_________�����ĵȵ����������ڷ��ӵ���_________����дһ�֣���
��5��ʵ��ʽΪCrCl3��6H2O�Ļ������������칹�壬����һ�ֿɱ�ʾΪ[Cr(H2O)4Cl2]Cl��H2O,���������������ṩ�µ��ӶԵ�ԭ��Ϊ_________����λ��Ϊ_________��
��6��NH3���ӿ�����H+�������NH4+,������̷����ı����_________(�����)��
a�����Ŀռ乹�� b��Nԭ�ӵ��ӻ����� c��H-N-H�ļ��� d�����ĵ�����
��7����̼Ԫ���γɵ�ij�־���ľ����ṹ��ͼ��ʾ,�������ӵ�������ֵΪNA,�����ܶ�Ϊpg/cm3,��þ������ⳤΪ_________pm��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС�鰴�������̣����к����е⺬���IJⶨ��
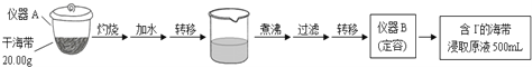
��1��д���������ƣ�A______��B______��
��2��ȡ20.00 mL����������ȡԭҺ����ϡH2SO4������KIO3��ʹI����IO3����ȫ��Ӧ�����Ե���Ϊָʾ������2.0��10��3mol/L��Na2S2O3��Һ�ζ�����I2ǡ����ȫ��Ӧʱ����ȥNa2S2O3��Һ20.00mL������֪��5I��+ IO3��+ 6H+=3I2 + 3H2O��I2 + 2S2O32��=2I��+ S4O62����
���ж���Na2S2O3��Һ�ζ�ǡ����ȫ��Ӧ��������______��
�ڼ���øɺ����е����������______����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺
��1���������������ʣ���̼60��C60������������Na2O�����CaF2�����P4O10�����̼���辧�壮�����������Ӿ������ �� ���ڷ��Ӿ������ �� ����ԭ�Ӿ������ ��
��2�������з��ӣ�HCN��P4��SO2��PCl3��BF3 �� �������ڷǼ��Է��ӵ��� ��
��3�����������ӣ�SO32����SO42����CO32�� �� ���пռ乹��Ϊ���������ε��� �� ����ԭ�ӵ��ӻ������������sp2�ӻ����� ��
��4��CaO������ͼ��ʾ��CaO������Ca2+����λ��Ϊ����ÿһ�������Ӿ���������Ҿ�����ȵĸ�����������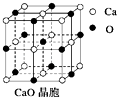
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʱ��������������������������������������������ϸ���к������Ļ������뺬�������л������ﹲ�еĻ�ѧԪ���� �� ��
A��C��H��O B��C��H��O��N C��H��O D��N��P��S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������C,H,O���л���3.24gװ��Ԫ�ط���װ�ã�ͨ��������O2ʹ֮��ȫȼ�գ������ɵ���������ͨ��CaCl2�ܣ�A���ͼ�ʯ�ң�B�������A������������2.16g��B��������9.24g����֪���л������Է�������Ϊ108��
��1��ȼ�մ��л���3.24g������O2����g��
��2������л���ķ���ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڲ��ϵ�˵��������ȷ���ǣ� ��
A.���������һ�����Ͻ�
B.��ά���Dz�˿����Ҫ�ɷ�
C.ˮ���������г����Ĺ����β���
D.����������������ά����Ҫԭ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com