
| 杂质 | 加入的试剂 |
| 硫酸盐 | ①BaCl2 |
| MgCl2 | ②NaOH |
| CaCl2 | ③Na2CO3 |
分析 从电离的角度分析粗盐中的杂质可知:溶液中的杂质离子为硫酸根离子、镁离子、和钙离子,硫酸根离子用钡离子沉淀,根据镁离子用氢氧根离子沉淀,钙离子用碳酸根离子沉淀,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.蒸发结晶操作时玻璃棒的作用是搅拌,防止局部过热使液体飞测.
解答 解:(1)为了不引入新的杂质,①加入过量BaCl2溶液,可除掉硫酸根离子,②加入过量NaOH溶液,可除掉镁离子,③加入过量Na2CO3溶液,可除掉钙离子;
故答案为:②NaOH ③Na2CO3;
(2)③中加入过量Na2CO3溶液不仅为了完全除去Ca2+,还可以将过量的钡离子沉淀,对氢氧化钠而言没有顺序要求,但碳酸钠要放在氯化钡之后,所以②③可以换顺序;
故答案为:②③; ③②;
(3)最后加适量的盐酸以调节溶液至中性并除去过量的CO32-,在除掉碳酸根、氢氧根后,得到氯化钠溶液,呈中性,氢离子与碳酸根反应生成二氧化碳和水;
故答案为:CO32-+2H+=H2O+CO2↑;
(4)蒸发结晶在蒸发皿中进行,蒸发皿放于铁架台的铁圈上,倒入液体不超过蒸发皿容积的2/3,加热时不断用玻璃棒搅拌液体防止受热不均,液体飞溅.看到有大量固体析出,或者仅余少量液体时,停止加热,利用余热将液体蒸干;
故答案为:搅拌,防止局部过热使液体飞测;看到有大量固体析出,或者仅余少量液体时.
点评 除杂问题是化学实验中的一类重要问题,除杂时不仅要能把杂质除掉,还不能引入新杂质,而且方法要简便易行,把握好此原则需要我们有扎实的基础知识和缜密的思维.


科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
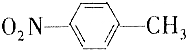 和
和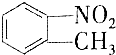 的一些物理性质如下表所示:
的一些物理性质如下表所示:| 物质 | 熔点 | 沸点 | 密度 | 水溶性 |
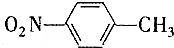 | -10℃ | 212℃ | 1.1622g/cm3 | 不溶于水 |
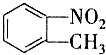 | 54℃ | 238℃ | 1.1581g/cm3 | 不溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
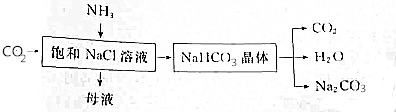
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H6O | B. | CH3O | C. | C4H12O2 | D. | C5H10O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
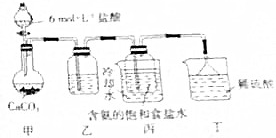
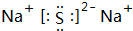 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | H | |||||||
| 二 | C | N | F | Ne | ||||
| 三 | Na | Al | P | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H6 | B. | C2H4 C3H6 | C. | C2H4 C3H4 | D. | C2H6 C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com