
【题目】研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 . ②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 .
(2)25℃,在0.10molL﹣1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如图(忽略溶液体积的变化、H2S的挥发). 
①pH=13时,溶液中的c(H2S)+c(HS﹣)=molL﹣1 .
②某溶液含0.020molL﹣1Mn2+、0.10molL﹣1H2S,当溶液PH=时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10﹣13]
(3)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K= .
②0.10molL﹣1Na2SO3溶液中离子浓度由大到小的顺序为 .
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 .
【答案】
(1)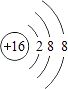 ; C+2H2SO4(浓)
; C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O
2SO2↑+CO2↑+2H2O
(2)0.043;5
(3)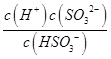 ; c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+); H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O
; c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+); H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O
【解析】解:(1)①S是16号元素.S原子获得2个电子变为S2﹣,硫离子的结构示意图为: 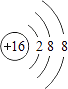 ,所以答案是:
,所以答案是: 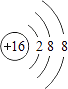 ;
;
②加热时,硫元素的最高价氧化物对应水化物的浓溶液是浓硫酸与木炭反应生成二氧化碳、二氧化硫和水,反应的方程式为:C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O,所以答案是:C+2H2SO4(浓)
2SO2↑+CO2↑+2H2O,所以答案是:C+2H2SO4(浓) ![]() 2SO2↑+CO2↑+2H2O;(2)①pH=13时,c(S2﹣)=5.7×10﹣2mol/L,在0.10molL﹣1H2S溶液中根据硫守恒c(H2S)+c(HS﹣)+c(S2﹣)=0.10molL﹣1,所以c(H2S)+c(HS﹣)=0.1﹣5.7×10﹣2=0.043mol/L,所以答案是:0.043;
2SO2↑+CO2↑+2H2O;(2)①pH=13时,c(S2﹣)=5.7×10﹣2mol/L,在0.10molL﹣1H2S溶液中根据硫守恒c(H2S)+c(HS﹣)+c(S2﹣)=0.10molL﹣1,所以c(H2S)+c(HS﹣)=0.1﹣5.7×10﹣2=0.043mol/L,所以答案是:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2﹣)= ![]() =
= ![]() =1.4×10﹣11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,所以答案是:5;(3)①HSO3﹣的电离方程式为:HSO3﹣H++SO32﹣,平衡常数表达式为K=
=1.4×10﹣11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,所以答案是:5;(3)①HSO3﹣的电离方程式为:HSO3﹣H++SO32﹣,平衡常数表达式为K= ![]() ,所以答案是:
,所以答案是: ![]() ;
;
②Na2SO3溶液显碱性,SO32﹣存在两步水解:SO32﹣+H2OHSO3﹣+OH﹣,HSO3﹣+H2OH2SO3+OH﹣,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+),所以答案是:c(Na+)>c(SO32﹣)>c(OH﹣)>c(HSO3﹣)>c(H+);
③由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3﹣,所以反应的主要离子方程式为H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O,而不是为H2SO3+2HCO3﹣=SO32﹣+2CO2↑+2H2O.所以答案是:H2SO3+HCO3﹣=HSO3﹣+CO2↑+H2O.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】下列有关元素周期表的说法正确的是( )
A.短周期是指第一、二、三、四周期
B.周期表中的第五列是第ⅤA族
C.元素周期表中含元素最多的族是第ⅢB族
D.元素周期表有18个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1L KNO3和Cu(NO3)2的混合溶液中c (NO3﹣)=4molL﹣1 , 用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况下),假定电解后溶液体积仍为1L,原混合溶液中c(K+)为( )
A.1molL﹣1
B.2molL﹣1
C.3molL﹣1
D.4molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示。

请回答下列问题。
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,写出反应(Ⅲ)的化学方程式:_______________________。
(2)若D为氯碱工业的重要产品,A、B、C 为均含有同一种金属元素的无机化合物,反应(Ⅲ)的离子方程式为________________________。
(3)若B为非金属单质,且B 所含元素的原子最外层电子数与内层电子数之和的比值为3: 5,则反应(Ⅲ)中氧化产物与还原产物的物质的量之比为______,0.1mol A与含0.15molNaOH 的溶液充分反应后,溶液中所含离子浓度的大小关系为______。(已知: 常温下H2S 的电离平衡常数Ka1= 1.3×10-7 Ka2=7.1×10-15)
(4)若A、B、C 的溶液均显碱性,C 为焙制糕点的发酵粉的主要成分之一。
①A中所含化学键类型为________,D的电子式为_________
②25℃时,浓度均为0.1mol/L 的B、C 溶液,pH 较大的是______(填溶质的化学式)溶液,写出B 溶液中显电中性的原因:__________________(用B 溶液中有关粒子的浓度关系表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是( )
A.Na2O、Na2O2、Fe2O3都是碱性氧化物
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.纯碱、烧碱、熟石灰都是碱
D.水玻璃、氯水、漂白粉均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酸雨是指pH小于7的降水
B.水泥、玻璃、水晶饰物和珍珠都是硅酸盐制品
C.城市空气质量报告中包括PM2.5、SO2、NO2、CO2等污染物
D.钢是用量最大、用途最广的合金,青铜是我国历史上最早使用的合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氟、氯、溴、碘的下列说法中,错误的是( )
A.原子半径依次减小B.原子核外电子层数依次增多
C.它们最外层电子数都是7D.原子核对最外层电子的引力依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗高血压药物洛沙坦是一种结构复杂的有机物,H是合成洛沙坦的一种中间体,其合成路线如下:

已知:I.
II. 酯和醇可发生如下交换反应:
(1)有机物H中含氧官能团的名称是_________。
(2)C![]() D 的反应类型是_________。
D 的反应类型是_________。
(3)A是饱和一元醇,A![]() B反应的化学方程式为_________。
B反应的化学方程式为_________。
(4)1 mol E水解生成2 mol CH3OH,E的结构简式是__________。
(5)E跟乙二醇在一定条件下能够发生反应生成聚合物,写出此反应的化学方程式_________。
(6)通过多步反应,将E分子中引入-NH2可得到F,F分子存在较好的对称关系,F的结构简式是_________。
(7)下列说法正确的是_______。(填字母)
a.A能发生取代反应、氧化反应、消去反应
b.1 mol H与足量的银氨溶液反应,能生成1 mol Ag
c.已知烯醇式结构![]() 不稳定,而G却可以稳定存在,其原因可能是由于基团间的相互影响
不稳定,而G却可以稳定存在,其原因可能是由于基团间的相互影响
(8)写出同时满足下列条件的F的一种同分异构体的结构简式_________。
a.与F具有相同种类和个数的官能团
b.能发生银镜反应
c.其核磁共振氢谱显示有四种不同化学环境的氢,峰面积比为2∶4∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氯化银、溴化银、硫化银的Ksp分别为1.56×10﹣10、7.7×10﹣13、6.3×10﹣50 , 某溶液中含有浓度均为 0.01mol/L 的Cl﹣、Br﹣、S2﹣ , 向该溶液中逐滴滴加0.01mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序是( )
A.Cl﹣、Br﹣、S2﹣
B.Br﹣、Cl﹣、S2﹣
C.S2﹣、Br﹣、Cl﹣
D.Br﹣、S2﹣、Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com