
| A. | 使用液化石油气可以完全杜绝厨房污染 | |
| B. | 为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒 | |
| C. | 氯化钠是家庭常用的防腐剂,可用来腌制食品 | |
| D. | 医疗上常用体积分数为70%~75%的酒精作消毒剂 |
科目:高中化学 来源: 题型:解答题
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.| 实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
| 1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液. | 先出现白色沉淀后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加多1滴NaOH溶液;振荡后将两支试管放在热水浴中温热 | 若A试管比B试管出现的银镜时间短、光亮,则溶液pH大,反应速率快;若A试管比B试管出现的银镜时间长,则溶液pH大,反应速率慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
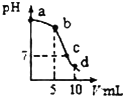 25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.
25℃时,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如如图所示.,则下列说法不正确的是( )已知:Ka(HCN)=6.4×10-10.| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为16的氧原子:${\;}_{16}^{8}$O | |
| B. | 苛性钠化学式:Na2CO3 | |
| C. | 镁离子结构示意图: | |
| D. | 次氯酸钠在水中电离:NaClO═Na++Cl-+O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O Ba(OH)2+H2SO4═BaSO4+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com