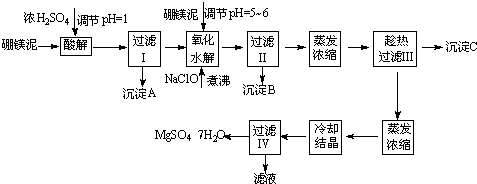
£Ø2009?¹ć¶«Ä£Äā£©Ķس£ĒéæöĻĀæÕĘųÖŠCO
2µÄĢå»ż·ÖŹżĪŖ0.030%£¬µ±æÕĘųÖŠCO
2µÄĢå»ż·ÖŹż³¬¹ż0.050%Ź±£¬»įŅżĘšĆ÷ĻŌµÄĪĀŹŅŠ§Ó¦£®ĪŖ¼õŠ”ŗĶĻū³żCO
2¶Ō»·¾³µÄÓ°Ļģ£¬Ņ»·½Ćꏥ½ēø÷¹ś¶¼ŌŚĻŽÖĘĘäÅÅ·ÅĮ棬ĮķŅ»·½ĆęæĘѧ¼Ņ¼ÓĒæĮĖ¶ŌCO
2““ŠĀĄūÓƵÄŃŠ¾æ£®
£Ø1£©ÄæĒ°£¬ÓĆ³¬ĮŁ½ēCO
2£ØĘäדĢ¬½éÓŚĘųĢ¬ŗĶŅŗĢ¬Ö®¼ä£©“śĢę·śĄū°ŗ×÷ÖĀĄä¼ĮŅŃ³ÉĪŖŅ»ÖÖĒ÷ŹĘ£¬ÕāŅ»×ö·Ø¶Ō»·¾³µÄ»ż¼«ŅāŅåŌŚÓŚ
±£»¤³ōŃõ²ć
±£»¤³ōŃõ²ć
£®
£Ø2£©×ī½üÓŠæĘѧ¼ŅĢį³ö”°ĀĢÉ«×ŌÓÉ”±¹¹Ļė£ŗ°ŃæÕĘų“µČėĢ¼Ėį¼ŲČÜŅŗ£¬Č»ŗóŌŁ°ŃCO
2“ÓČÜŅŗÖŠĢįČ”³öĄ“£¬¾»Æѧ·“Ó¦ŗóŹ¹Ö®±äĪŖæÉŌŁÉśČ¼ĮĻ¼×“¼£®”°ĀĢÉ«×ŌÓÉ”±¹¹Ļė¼¼ŹõĮ÷³ĢČēĻĀ£ŗ

¢Ł·Ö½ā³ŲÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ
£®
¢ŚŌŚŗĻ³ÉĖžÖŠ£¬ČōÓŠ4.4kg CO
2Óė×ćĮæH
2Ē”ŗĆĶźČ«·“Ó¦£¬Éś³ÉĘųĢ¬µÄĖ®ŗĶ¼×“¼£¬æɷųö4947kJµÄČČĮ棬ŹŌŠ“³öŗĻ³ÉĖžÖŠ·¢Éś·“Ó¦µÄČČ»Æѧ·½³ĢŹ½
CO2£Øg£©+3H2£Øg£©ØTCH3OH£Øg£©+H2O£Øg£©”÷H=-49.47kJ/mol
CO2£Øg£©+3H2£Øg£©ØTCH3OH£Øg£©+H2O£Øg£©”÷H=-49.47kJ/mol
£®
£Ø3£©Š”ĄīĶ¬Ń§ÄāÓĆ³Įµķ·Ø²ā¶ØæÕĘųÖŠCO
2µÄĢå»ż·ÖŹż£¬Ėū²éµĆCaCO
3ӢBaCO
3µÄČܶȻż£ØKsp£©·Ö±šĪŖ4.96”Į10
-9”¢2.58”Į10
-11£®
Š”ĄīÓ¦øĆŃ”ÓƵďŌ¼ĮŹĒ
Ba£ØOH£©2£Ø»ņNaOHČÜŅŗŗĶBaCl2ČÜŅŗ£©
Ba£ØOH£©2£Ø»ņNaOHČÜŅŗŗĶBaCl2ČÜŅŗ£©
£¬ŹµŃ鏱²ā¶ØµÄŹż¾Ż³żæÕĘųµÄĢå»żĶā£¬»¹ŠčŅŖ²ā¶Ø
ŹµŃ鏱µÄĪĀ¶Č”¢Ń¹Ē攢³ĮµķµÄÖŹĮæ
ŹµŃ鏱µÄĪĀ¶Č”¢Ń¹Ē攢³ĮµķµÄÖŹĮæ
£®






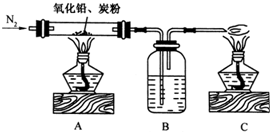 £Ø2009?¹ć¶«Ä£Äā£©Ä³æĪĶāŠ”×éÓūĶعżŹµŃéÖ¤Ć÷·½Ē¦æó·Ö½āĖłµĆ°×É«·ŪÄ©ÖŠŗ¬ÓŠŃõŌŖĖŲ£¬Éč¼ĘŅŌĻĀµÄŹµŃé×°ÖĆ£ŗ
£Ø2009?¹ć¶«Ä£Äā£©Ä³æĪĶāŠ”×éÓūĶعżŹµŃéÖ¤Ć÷·½Ē¦æó·Ö½āĖłµĆ°×É«·ŪÄ©ÖŠŗ¬ÓŠŃõŌŖĖŲ£¬Éč¼ĘŅŌĻĀµÄŹµŃé×°ÖĆ£ŗ