
【题目】2017年12月19日,中国绿色碳汇基金会印发《关于授予江口县“碳汇城市”称号的决定》。我市江口县成为全国第三个、我省首个“碳汇城市”。碳汇,是指通过植树造林、森林管理、植被恢复等措施,利用植物光合作用吸收大气中的二氧化碳6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g) ,并将其固定在植被和土壤中,从而减少温室气体在大气中浓度的过程、活动或机制。已知每吸收1molCO2需要吸收能量约为470kJ.据此回答下列问题:
(1)碳汇过程中能量的转化形式由__________能转化为___________能;据相关资料表明,每1m3林木,大约能吸收能量为1.88×107kJ,大约可以吸收CO2______吨;葡萄糖燃烧的热化学方程式为:_____________ 。
(2)工业废气中的CO2可用碱液吸收。所发生的反应如下:
CO2(g)+2NaOH(aq)===Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1
CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-b kJ·mol-1
则:①反应CO2(g)+H2O(l)+Na2CO3(aq)===2NaHCO3(aq)的ΔH=______ kJ·mol-1(用含a、b的代数式表示)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3和CO2一样是一种温室气体 ,在大气中的寿命可长达740年之久。以下是几种化学键的键能:
化学键 | N≡N | F—F | N—F |
键能/kJ·mol-1 | 941.7 | 154.8 | 283.0 |
①反应:N2(g)+3F2(g)=2NF3(g)ΔH=_________________
②下列说法中不正确的有_____________
A.过程:N2(g)![]() 2N放出能量
2N放出能量
B.过程:N+3F![]() NF3(g)放出能量
NF3(g)放出能量
C.使用催化剂能减小反应的ΔH
【答案】 太阳 化学 1.76 C6H12O6(s)+6O2(g)= 6CO2(g) +6H2O(l)ΔH=-2820kJ/mol a-2b)kJ/mol -291.9kJmol-1 AC
【解析】(1)根据题意,碳汇过程中能量的转化形式太阳能转化为化学能;据相关资料表明,每1m3林木,大约能吸收能量为1.88×107kJ,则吸收的二氧化碳的物质的量为![]() =4×104mol,大约可以吸收CO2的质量为4×104mol×44g/mol=1.76×106g=1.76吨;吸收1molCO2需要吸收能量约为470kJ,则吸收6mol二氧化碳吸收的能量为470kJ×6=2820kJ,6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g),ΔH=+2820kJ/mol,因此C6H12O6(s)+6O2(g)= 6CO2(g) +6H2O(l) ΔH=-2820kJ/mol,故答案为:太阳;化学;1.76;C6H12O6(s)+6O2(g)= 6CO2(g) +6H2O(l) ΔH=-2820kJ/mol;
=4×104mol,大约可以吸收CO2的质量为4×104mol×44g/mol=1.76×106g=1.76吨;吸收1molCO2需要吸收能量约为470kJ,则吸收6mol二氧化碳吸收的能量为470kJ×6=2820kJ,6CO2(g) +6H2O(l) === C6H12O6(s)+6O2(g),ΔH=+2820kJ/mol,因此C6H12O6(s)+6O2(g)= 6CO2(g) +6H2O(l) ΔH=-2820kJ/mol,故答案为:太阳;化学;1.76;C6H12O6(s)+6O2(g)= 6CO2(g) +6H2O(l) ΔH=-2820kJ/mol;
(2)已知①CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l)△H=-a kJ/mol,②CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-b kJ/mol,由盖斯定律:②×2-①得 CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的△H=(a-2b)kJ/mol,故答案为:(a-2b)kJ/mol;
(3)①因为反应热等于反应物的总键能减去生成物的总键能,所以反应N2(g)+3F2(g)=2NF3(g)△H=(941.7+3×154.8-283.0×6)kJmol-1=-291.9kJmol-1,故答案为:-291.9kJmol-1;
②A.N2(g)→2N(g)为化学键的断裂过程,应吸收能量,故A错误;B.N(g)+3F(g)→NF3(g)为形成化学键的过程,放出能量,故B正确;C.使用催化剂不能改变反应的ΔH,故C错误;故选AC。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)制取氯气时,在烧瓶中先加入一定量的二氧化锰固体,再通过__________(填写仪器名称)向烧瓶中加入适量的____________(填写试剂名称)。写出该反应的化学方程式并用双线桥法标出电子转移的方向和数目_________________________。
(2)为除去氯气中混有的杂质气体,可在①和②之间安装盛有__________(选填字母编号)的净化装置。
a. 碱石灰 b. 饱和食盐水 c. 浓硫酸 d. 饱和碳酸氢钠溶液
(3)③中发生反应的化学方程式______________________________________。比较制取氯酸钾和次氯酸钠的条件,可以初步得到的结论是:_____________________。
(4)反应完毕经冷却后,②的试管中有大量晶体析出,图中符合该晶体溶解度随温度变化规律的曲线是___________(选填字母);从②的试管中分离该晶体的操作是___________ (填写实验操作名称)。

(5)实验中可观察到④的试管中溶液颜色会发生变化:最初溶液由紫色变为 _______,随后溶液逐渐变为无色,是因为发生了反应______________(写化学方程式)。
(6)一定量的氢气在过量氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用质量分数为98%、密度为1.84g·cm-3的浓硫酸来配制500mL 0.2mol/L的稀硫酸。可供选择的仪器:①玻璃棒,②烧瓶,③烧杯,④胶头滴管,⑤量筒,⑥容量瓶,⑦托盘天平,⑧药匙。
请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的仪器有______(填代号)。
(2)配制溶液时,一般可以分为以下几个步骤:
①量取②计算③稀释④摇匀⑤移液⑥洗涤⑦定容⑧冷却⑨初步振荡⑩装瓶贴签
其正确的操作顺序为②①③______⑥_____④⑩(填序号)。
(3)经计算,需浓硫酸的体积为______mL。现有①10mL、②50mL、③100mL三种规格的量筒,应选用的量筒是_______(填代号)。
(4)在配制过程中,其他操作都准确,下列操作中错误且能使所配溶液浓度偏高的有____ (填代号)
①洗涤量取浓硫酸后的量筒,并将洗涤液转入容量瓶中
②未等稀释后的硫酸溶液冷却至室温就转入容量瓶内
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑦定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是材料科学发展的基础,随着科学技术的发展,已研制出许多新型材料。下列属于新型陶瓷材料的是
A. 玻璃 B. 水泥 C. 生物陶瓷 D. 陶瓷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
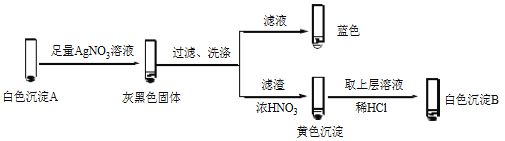
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作所对应的现象以及结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用坩埚钳夹住一小块用砂纸打磨过的铝箔,在酒精灯上加热 | 铝箔熔化并滴落 | 金属铝的熔点较低 |
B | 先向某溶液滴加H2O2,然后再滴加几滴KSCN溶液 | 溶液变为红色 | 该溶液中一定含有Fe2+ |
C | 在KI溶液中滴加少量氯水,再加入CCl4,充分振荡 | 液体分层,下层溶液呈紫红色 | 氯的非金属性强于碘 |
D | 向1mL0.1mol/LMgCl2溶液中先滴1~2滴2mol/LNaOH溶液,再滴加2滴0.1mol/L FeCl3溶液,静置 | 先有白色沉淀生成,后白色沉淀变为红褐色 | Ksp[Mg(OH)2]<Ksp[Fe(OH)3] |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是第VA族的元素,它们的单质及其化合物在生产生活中均有重要作用。请回答以下问题:
(1) 基态砷原子的最外层电子排布式为______;有_____个能级。
(2) N、P、As原子的第一电离能由大到小的顺序为________。
(3) 氮元素的一种重要化合物尿素CO(NH2)2分子中,σ键和π键的数目之比为______。
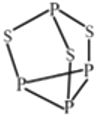
(4) P4S3 可用于制造火柴,其分子结构如图所示,判断P4S3 分子中硫原子的杂化轨道类型为_____,每个P4S3 分子中含孤电子对的数目为_______。
(5) Na3AsO4 可用作杀虫剂,AsO43-的空间构型为_______,与AsO43-互为等电子体的一种分子为_____ (填写化学式)。
(6) ①砷化镓(GaAs) 为黑灰色固体,熔点为1238℃,其晶胞结构如图所示。该晶体属于____晶体,微粒之间存在的作用力是_______。

② 砷化镓晶胞中距离Ga原子等距且最近的Ga原子有______个,已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的值_______(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.苹果中含有的戊酸戊酯有芳香气味,易溶于水
B.用NaHCO3溶液可以鉴别乙醇、乙酸和乙酸乙酯
C.通式相同的不同物质一定属于同系物
D.淀粉、油脂、甘氨酸在一定条件下都能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积的Na2SO4、KAl(SO4)2、Al2(SO4)3三种溶液分别与等体积、等浓度的BaCl2溶液恰好完全反应,则三溶液的物质的量浓度之比为()
A. 1:2:3 B. 6:3:2 C. 2:3:6 D. 1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com