
氨气具有广泛的用途.
(1)工业上合成氨反应的化学方程式是N2+3H2 2NH3.
2NH3.
(2)实验室常用如图所示装置制取并收集氨气.
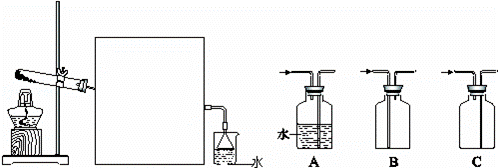
①实验室制取氨气反应的化学方程式是 .
②图中方框内收集氨气的装置可选用 (填字母序号).
③尾气处理装置中使用倒扣漏斗的作用是 .
(3)工业上用NH3制取NO反应的化学方程式是 .
考点: 氨的实验室制法.
专题: 实验题.
分析: (1)工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应是可逆反应;
(2)①实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气;
②氨气的密度比空气的密度小,所以要用向下排空气法收集氨气;
③氨气极易溶于水,倒扣漏斗空间大,能防止倒吸;
(3)NH3和氧气在催化剂的作用下发生反应生成一氧化氮和水;
解答: 解:(1)工业合成氨是氢气和氮气在高温高压催化剂作用下反应生成氨气,反应是可逆反应,反应的化学方程式为:N2+3H2 2NH3,
2NH3,
故答案为:N2+3H2 2NH3;
2NH3;
(2)①实验室用氢氧化钙和氯化铵在加热条件下反应制备氨气,反应的化学方程式为Ca(OH)2+2NH4Cl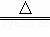 CaCl2 +2H2O+2NH3↑,
CaCl2 +2H2O+2NH3↑,
故答案为:Ca(OH)2+2NH4Cl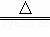 CaCl2 +2H2O+2NH3↑;
CaCl2 +2H2O+2NH3↑;
②氨气极易溶于水,密度比空气小,所以收集氨气可选用向下排空气法,根据进气方向应该用C装置,
故答案为:C;
③氨气极易溶于水,倒置漏斗有缓冲作用,气体能充分被吸收且防止倒吸,
故答案为:防止烧杯中的水倒吸;
(3)工业上用NH3和氧气在催化剂的作用下发生反应制取一氧化氮,该反应的化学方程式为:4NH3+5O2 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2 4NO+6H2O;
4NO+6H2O;
点评: 本题考查了氨气的性质和制取,掌握铵盐和氨气的性质是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 浓NaOH溶液与浓CaCl2溶液混合:Ca2++2OH﹣=Ca(OH)2↓
B. 氯化铝溶液中滴加氨水生成沉淀:Al3++3OH﹣=Al(OH)3↓
C. 利用醋酸溶解含碳酸钙的水垢CaCO3+2H+=Ca2++H2O+CO2↑
D. NaHSO4溶液中滴加NaHCO3溶液:2H++CO32﹣=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期元素的性质与原子(或分子)结构如下表:
元素编号 元素性质与原子(或分子)结构
T 最外层电子数是次外层电子数的3倍
X 常温下,单质为双原子分子,分子中含有3对共用电子对,其简单氢化物的水溶液显碱性
Y M层比K层少1个电子
Z 第3周期元素的简单离子中半径最小的,其氧化物呈两性
(1)画出元素T原子结构示意图 ;
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是 (填序号);
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的化学式为 .
(4)元素T和氢元素以原子个数比1:1形成的化合物的电子式为 ,元素Z最高价氧化物的水化物与元素Y的最高价氧化物的水化物的溶液相互反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
用10mL的0.1mol•L﹣1 BaCl2溶液恰好可使相同体积的硫酸铁(Fe2(SO4)3)、硫酸锌(ZnSO4)和硫酸钾(K2SO4)三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是()
A. 3:2:2 B. 1:2:3 C. 1:3:3 D. 3:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
福岛核电站泄漏的放射性物质中含有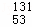 I,下列有关
I,下列有关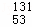 I的说法正确的是()
I的说法正确的是()
A. 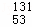 I是碘元素的一种同位素
I是碘元素的一种同位素
B. 由此可确定碘元素的相对原子质量为131
C. 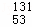 I核素中含中子数为53
I核素中含中子数为53
D. 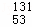 I2的摩尔质量为262 g
I2的摩尔质量为262 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语使用正确的是()
A. 氟化镁的电子式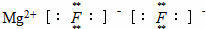
B. 用电子式表示硫化氢的形成过程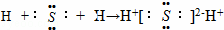
C. HClO的结构式 H﹣O﹣Cl
D. Cl﹣离子的结构示意图
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子中中心原子价层电子对几何构型为四面体且分子或离子空间的构型为V形的是( )
|
| A. | NH4+ | B. | PH3 | C. | H3O+ | D. | OF2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com