
分析 (1)该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,得电子的反应物是氧化剂、失电子的反应物是还原剂;
(2)化合价升高元素失电子,所在反应物是还原剂,对应产物是氧化产物,化合价降低元素得到电子,所在反应物是氧化剂,对应产物是还原产物,化合价升高数=化合价降低数=转移电子数.
解答 解:(1)该反应中,Cl元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,所以Cl2是氧化剂、SO2是还原剂,其转移电子数是2,转移电子数目和方向为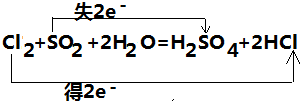 ,
,
故答案为: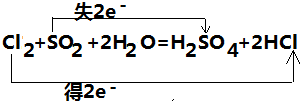 ;Cl2;SO2;
;Cl2;SO2;
(2)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为 ;化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素得,所在反应物MnO2是氧化剂,
;化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素得,所在反应物MnO2是氧化剂,
故答案为: ;MnO2;浓HCl.
;MnO2;浓HCl.
点评 本题考查了氧化还原反应,根据元素化合价变化分析解答,再结合基本概念解答,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | V[C6H5OH(aq)]=20mL时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| C. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| D. | V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | 铁与足量的稀硝酸溶液反应放出NO气体:Fe+4H++NO3-═Fe3++2H2O+NO↑ | |
| D. | 溴化亚铁溶液与少量氯水混合:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com