
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。通过对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
(1)反应2NO2(g) ![]() N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。
N2(g)+2O2(g),设起始时容器中只有NO2,平衡时三种物质的物质的量与温度关系如图所示。

则A点时,NO2的转化率为_______________,B点时,设容器的总压为a Pa,则平衡常数Kp为____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)向2 L密闭容器中加入2 mol CO2和6 mol H2,在适当的催化剂作用下,下列反应能自发进行:CO2(g)+3H2(g)![]() CH3OH(g) +H2O(g)。
CH3OH(g) +H2O(g)。
①该反应ΔH_______0(填“>”、“<”或“=”)
②下列叙述能说明此反应达到平衡状态的是____________。(填字母)
a.混合气体的平均相对分子质量保持不变
b.1 mol CO2生成的同时有3 mol H—H键断裂
c.CO2的转化率和H2的转化率相等
d.混合气体的密度保持不变
③ 反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
CH3OH(g)+H2O(g),在起始温度(T1℃)、体积相同(2L)的两密闭容器中,改变条件,反应过程中部分数据见下表:
反应时间 | CO2/mol | H2/mol | CH3OH/mol | H2O/mol | |
反应Ⅰ:恒温恒容 | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应Ⅱ:绝热恒容 | 0 min | 0 | 0 | 2 | 2 |
反应Ⅰ,前10min内的平均反应速率v(CH3OH)=_______________________________。达到平衡时,反应Ⅰ、Ⅱ对比:平衡常数K(I)____________K(II)(填“>”、“<”或“=”);平衡时CH3OH的浓度c(I)____________c(II)(填“>”、“<”或“=”)。
【答案】50% a Pa<ab0.025 mol·L-1 ·min-1>>
【解析】
(1)根据化学方程式2NO2(g) ![]() N2(g)+2O2(g)及图示数据,A点时NO2是10mol,O2是10mol,N2是5mol,所以NO2初始物质的量是20mol,则NO2的转化率为
N2(g)+2O2(g)及图示数据,A点时NO2是10mol,O2是10mol,N2是5mol,所以NO2初始物质的量是20mol,则NO2的转化率为![]() 50%;B点时NO2和N2物质的量相等,设为xmol,则O2是2xmol,因为容器的总压为a Pa,所以NO2和N2的分压都是
50%;B点时NO2和N2物质的量相等,设为xmol,则O2是2xmol,因为容器的总压为a Pa,所以NO2和N2的分压都是![]() a Pa,O2的分压是
a Pa,O2的分压是![]() a Pa,则平衡常数Kp=
a Pa,则平衡常数Kp=![]() =
= 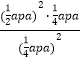 =aPa;(2)①由方程式可看出该反应S<0,因为反应能自发进行,所以H-TS<0,则H<0;②a、混合气体的平均相对分子质量=气体总质量÷物质的量,该反应的反应物和生成物都是气体,物质的量变化,根据质量守恒定律,所以混合气体的平均相对分子质量变化,则当混合气体的平均相对分子质量保持不变时,达到了平衡状态,故a正确;b、1molCO2生成同时有3molH-H键断裂,即消耗3molH2,根据化学反应方程式,能说明正逆反应速率相等,则达到了平衡状态,故b正确;c、开始充入2molCO2和6molH2,投料比等于化学方程式系数比,CO2和H2的转化率始终相等,不能说明正逆反应速率相等,不一定达到平衡状态,故c错误;d、混合气体的密度等于气体质量和体积的比值,反应前后质量守恒,体积不变,所以密度始终不变,密度保持不变时不一定是平衡状态,故d错误。答案选ab;③由表中数据可知,反应Ⅰ前10min内反应的H2为:(6-4.5)mol=1.5mol,根据化学方程式可得,生成CH3OH为:
=aPa;(2)①由方程式可看出该反应S<0,因为反应能自发进行,所以H-TS<0,则H<0;②a、混合气体的平均相对分子质量=气体总质量÷物质的量,该反应的反应物和生成物都是气体,物质的量变化,根据质量守恒定律,所以混合气体的平均相对分子质量变化,则当混合气体的平均相对分子质量保持不变时,达到了平衡状态,故a正确;b、1molCO2生成同时有3molH-H键断裂,即消耗3molH2,根据化学反应方程式,能说明正逆反应速率相等,则达到了平衡状态,故b正确;c、开始充入2molCO2和6molH2,投料比等于化学方程式系数比,CO2和H2的转化率始终相等,不能说明正逆反应速率相等,不一定达到平衡状态,故c错误;d、混合气体的密度等于气体质量和体积的比值,反应前后质量守恒,体积不变,所以密度始终不变,密度保持不变时不一定是平衡状态,故d错误。答案选ab;③由表中数据可知,反应Ⅰ前10min内反应的H2为:(6-4.5)mol=1.5mol,根据化学方程式可得,生成CH3OH为:![]() =0.5mol,前10min内的平均反应速率v(CH3OH)=
=0.5mol,前10min内的平均反应速率v(CH3OH)=![]() =0.025 molL-1min-1;前面已知该反应H<0,为放热反应,又因为反应Ⅰ为恒温恒容条件,反应Ⅱ为绝热恒容条件,所以反应Ⅱ相当于升温,化学平衡常数减小,故K(I)>K(II);反应Ⅱ中若把CH3OH和H2O(g)的初始物质的量全部转化为CO2和H2,与反应Ⅰ初始物质的量对应相等,但反应Ⅱ温度高于反应Ⅰ,所以反应Ⅱ相当于在和反应Ⅰ等效的基础上又升高温度,平衡逆向移动,故平衡时CH3OH的浓度c(I)>c(II)。
=0.025 molL-1min-1;前面已知该反应H<0,为放热反应,又因为反应Ⅰ为恒温恒容条件,反应Ⅱ为绝热恒容条件,所以反应Ⅱ相当于升温,化学平衡常数减小,故K(I)>K(II);反应Ⅱ中若把CH3OH和H2O(g)的初始物质的量全部转化为CO2和H2,与反应Ⅰ初始物质的量对应相等,但反应Ⅱ温度高于反应Ⅰ,所以反应Ⅱ相当于在和反应Ⅰ等效的基础上又升高温度,平衡逆向移动,故平衡时CH3OH的浓度c(I)>c(II)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关氧化还原反应的叙述中,正确的是
A. 一定有氧元素参加 B. 氧化反应一定先于还原反应发生
C. 氧化剂本身发生氧化反应 D. 一定有电子转移(得失或偏向)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 32 g O2占的体积约为22.4 L
B. 1mol N2 含阿伏加德罗常数个氮原子
C. 在标准状况下,22.4 L H2O 的质量约为 18 g
D. 22 g CO2 与标准状况下11.2 L HCl 含有相同分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,⊿S<0的是: ( )
A.干冰的升华B.NH3 (g) +HCl (g) =NH4Cl (s)
C.氯化钠溶于水中D.CaCO3 (s) 分解为CaO (s) 和CO2(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )

A. 分子式为C7H6O5
B. 分子中含有2种官能团
C. 可发生加成和取代反应
D. 在水溶液中羧基和羟基均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的键线式如下所示。下列说法中不正确的是( )
![]()
A. X的分子式为C8H8
B. 有机物Y是X的同分异构体,且属于芳香烃,则Y的结构简式为![]()
C. X能使KMnO4酸性溶液褪色
D. X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯化物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A. 在标准状况下,1mol任何气体单质均含有2NA个原子
B. 1molCH3+(碳正离子)中含电子数目为10NA
C. 常温下,在18g![]() 中含有
中含有![]() 个氧原子
个氧原子
D. 在标准状况下,22.4L甲烷和22.4L H2O中含电子数均为10NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com