
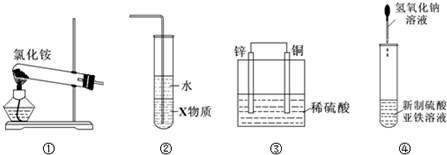
| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③是原电池,锌电极为负极,发生还原反应 | |
| D. | 装置④可用于制备氢氧化亚铁并观察其颜色 |
分析 A.氯化铵受热易分解,在温度较低时又重新生成氯化铵;
B.为防止倒吸,X物质的密度比水的大,且与水不互溶;
C.铜锌原电池中,锌较活泼,做原电池的负极;
D.氢氧化亚铁具有还原性,易被空气中氧气氧化.
解答 解:A.因氯化铵受热易分解,在温度较低时又重新生成氯化铵,不能只用氯化铵制备氨气,实验室用氢氧化钙和氯化铵在加热条件下制备氨气,故A错误;
B.氨气不溶于四氯化碳,但易溶于水,四氯化碳的密度比水大,氨气从四氯化碳进入水中可被吸收,有效防止倒吸,故B正确;
C.铜、锌、硫酸原电池中,锌较活泼,做原电池的负极,失电子被氧化,故C错误;
D.氢氧化亚铁易被氧化,应注意隔绝空气,应用胶头滴管插入到硫酸亚铁液面以下,故D错误.
故选B.
点评 本题考查化学实验基本操作、原电池原理,题目难度不大,注意B选项中防止倒吸的原理,为易错点.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | $\overline{v}$(O2)=0.01mol/(L•s) | B. | $\overline{v}$(NO)=0.08mol/(L•s) | ||
| C. | $\overline{v}$(H2O)=0.0013mol/(L•s) | D. | $\overline{v}$(NH3)=0.002mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | O |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
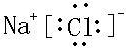 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两元素可形成化合物BA2 | |
| B. | A元素位于元素周期表第二周期第VIA族 | |
| C. | A、B两元素形成的化合物能与碳反应形成单质B | |
| D. | A、B两元素形成的化合物是两性化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜丝燃烧法可确定有机物中是否存在氮、氯和硫等元素 | |
| B. | 减压分馏、常压分馏都是物理变化 | |
| C. | 甲烷与氯气在光照条件下反应是一个自由基型链反应 | |
| D. | 液化石油气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
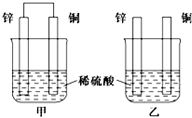 (1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:
(1)将纯锌片和纯铜片按如图方式插入相同浓度的稀硫酸中一段时间,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com